
 合金贮氢材料具有优异的吸收氢性能,在配合氢能的开发中起到重要作用.
合金贮氢材料具有优异的吸收氢性能,在配合氢能的开发中起到重要作用.分析 (1)zMHx(s)+H2(g)?zMHy(s)中遵循质量守恒定律,则反应前后H原子个数相同;吸氢速率v=$\frac{\frac{240ml}{2g}}{4min}$;由图可知,相同氢原子与金属原子的个数比时,T2温度高,对应的平衡时氢气的压强大,则升高温度,平衡逆向移动;
(2)T2温度高,对应的平衡时氢气的压强大,则升高温度,平衡逆向移动,则该反应为放热反应,低温下有利于吸收氢;当反应(Ⅰ)处于图中a点时,保持温度不变,向恒容体系中通入少量氢气,因温度不变,K不变,则平衡时氢原子与金属原子的个数比增大,平衡点在曲线AB上;释放氢气即为平衡逆向移动,结合该反应为放热反应、气体体积减小的反应特点解答;
解答 解:(1)zMHx(s)+H2(g)?zMHy(s)中遵循质量守恒定律,则反应前后H原子个数相同,则zx+2=zy,解得z=$\frac{2}{y-x}$;吸氢速率v=$\frac{\frac{240ml}{2g}}{4min}$=30mL•g-1•min-1;由图可知,相同氢原子与金属原子的个数比时,T2温度高,对应的平衡时氢气的压强大,则升高温度,平衡逆向移动,可知正反应△HⅠ<0,
故答案为:$\frac{2}{y-x}$;30;<;
(2)T2温度高,对应的平衡时氢气的压强大,则升高温度,平衡逆向移动,则该反应为放热反应,低温下有利于吸收氢,T1<T2时,则η(T1)>η(T2);当反应(Ⅰ)处于图中a点时,保持温度不变,向恒容体系中通入少量氢气,因温度不变,K不变,平衡时氢原子与金属原子的个数比增大,平衡点在曲线AB上,则达到平衡后反应(Ⅰ)可能处于图中的c点;释放氢气即为平衡逆向移动,因该反应为放热反应、气体体积减小的反应,则该贮氢合金可通过加热或减压的方式释放氢气,
故答案为:>;c;加热;减压;
点评 本题涉及化学平衡、化学反应速率及图象分析,把握平衡移动的影响因素、图象中纵横坐标的含义为解答的关键,(2)为解答的难点,侧重分析与应用能力的综合考查,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 18H2O含有的氢原子数目为NA | |
| B. | 1molFe与足量盐酸反应失去的电子数为3NA | |
| C. | 标准状况下,22.4L等物质的量的CO2和O2混合气体中含有氧原子数为2NA | |
| D. | 2mol•L-1NaCl溶液中含有Na+个数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 压强(Pa) | 4×105 | 6×105 | 10×105 | 20×105 |
| D的浓度(mol/L) | 0.085 | 0.126 | 0.200 | 0.440 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
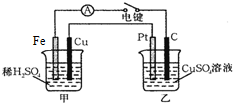 原电池和电解池都能实现能量的置换.回答下列问题:
原电池和电解池都能实现能量的置换.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇和乙醚互为同分异构体 | |
| B. | 干馏煤可以得到甲烷、苯和氨等重要化工原料 | |
| C. | 乙醇和乙酸之间能发生酯化反应,酯化反应和皂化反应互为逆反应 | |
| D. | 在酸性条件下,蔗糖水解的化学方程式为 C12H22O11+H2O→2C6H12O6(葡萄糖) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解质AgNO3溶液的浓度变为0.08mol/L | |
| B. | 阳极上产生112mLO2(标况) | |
| C. | 转移1.204×1022个电子 | |
| D. | 反应中有0.01mol的Ag被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向溶液中加入0.245g Cu(OH)2 | B. | 向溶液中加入0.31gCuCO3 | ||
| C. | 向溶液中加入0.0025 molH2SO4 | D. | 向溶液中加入0.2gCuO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
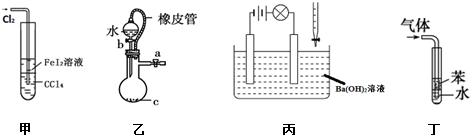
| A. | 甲装置可以用于比较Fe3+、I2、Cl2的氧化性强弱 | |
| B. | 乙装置中打开分液漏斗活塞,水不能顺利流下,说明该装置气密性良好 | |
| C. | 丙装置中若向Ba(OH)2溶液中逐滴加入硫酸溶液直至过量,灯光会由亮变暗至熄灭后又逐渐变亮 | |
| D. | 丁装置不能用于吸收HCl气体及防倒吸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com