
(6分)下表是元素周期表的一部分,请回答有关问题:
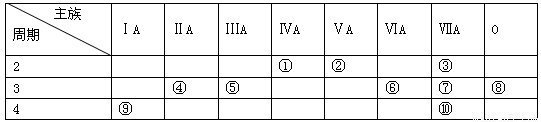
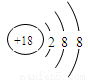
(1)表中化学性质最不活泼的元素,其原子结构示意图为 。
(2)表中能形成两性氢氧化物的元素是 (用元素符号表示),写出该元素的单质与⑨最高价氧化物的水化物反应的化学方程式 。
(3)①、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是 (填化学式)。
(4)③元素与⑩元素两者核电荷数之差是 。
(1)
(2)Al, 2Al+ 2KOH+2H2O === 2KAlO2+3H2↑
(3)HClO4
(4)26
【解析】
试题分析:由元素在元素周期表中的位置推断出元素种类,再利用相关元素的原子结构和性质来解答。(1)表中化学性质最不活泼的元素为⑧氩元素,其原子结构示意图见答案;(2)表中能形成两性氢氧化物的元素是⑤Al,Al与⑨元素钾的最高价氧化物的水化物氢氧化钾反应的化学方程式为
2Al+ 2KOH+2H2O === 2KAlO2+3H2↑ ;(3)C、S、Cl三种元素的非金属性:Cl>S>C,最高价氧化物的水化物中酸性最强的是HClO4。(4)③元素F为9号元素,⑩元素Br为35号元素,两者核电荷数之差是26。
考点:考查元素周期表及相关元素的性质、单质及化合物的性质。


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源:2013-2014广东中山一中、宝安中学等高三七校5月联考化学试卷(解析版) 题型:选择题
在水溶液中能大量共存的一组是
A.Fe2+、Na+、ClO-、Cl- B.Al3+、Mg2+、SO42-、CO32-
C.H+、Ca2+、Cl-、NO3- D.AlO2-、Cl-、H+、K+
查看答案和解析>>
科目:高中化学 来源:2013-2014山西省第二学期期末考试高二化学试卷(解析版) 题型:选择题
下列说法不正确的是( )
A.麦芽糖及其水解产物均能发生银镜反应
B.用溴水即可鉴别苯酚溶液、2,4?己二烯和甲苯
C.在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH
D.用甘氨酸(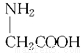 )和丙氨酸(
)和丙氨酸(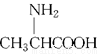 )缩合最多可形成4种二肽
)缩合最多可形成4种二肽
查看答案和解析>>
科目:高中化学 来源:2013-2014山西省第二学期期末考试高一化学试卷(解析版) 题型:选择题
下列哪种方法能制得纯净的氯乙烷( )
A.乙烷与氯气反应 B.乙烯与氯气反应
C.乙烯与氯化氢反应 D.用聚氯乙烯分解得到
查看答案和解析>>
科目:高中化学 来源:2013-2014山西省高一下学期期中化学试卷(解析版) 题型:计算题
(6分)由Zn—Cu—H2SO4组成的原电池,工作一段时间后,锌片的质量减少了6.5g。求:
(1)原电池生成氢气_______L(标准状况)。
(2)已知:1mol氢气完全燃烧放出285.8kJ的热量。将(1)中获得的氢气燃烧,可以得到_________kJ的热量。
(3)若起始时刻两电极质量相等,将电解质溶液改为硫酸铜溶液,当电池输出相同的电量时,电池两极的质量差为__________g。
查看答案和解析>>
科目:高中化学 来源:2013-2014山西省高一下学期期中化学试卷(解析版) 题型:选择题
下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是( )
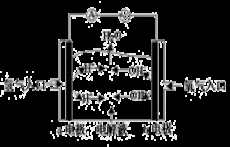
A.a电极是负极
B.b电极的电极反应为:4OH--4e-==2H2O+O2↑
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储存电池内的新型发电装置
查看答案和解析>>
科目:高中化学 来源:2013-2014山西省高一下学期期中化学试卷(解析版) 题型:选择题
关于含正离子N5+的化合物N5ASF6,下列叙述中错误的是( )
A.N5+共有34个核外电子 B.N5+中氮原子间以共价键结合
C.化合物N5ASF6中AS的化合价为+1价 D.化合物N5ASF6中F的化合价为 -1价
查看答案和解析>>
科目:高中化学 来源:2013-2014山西省5月月考高二化学试卷(解析版) 题型:选择题
做乙醛被新制Cu(OH)2氧化实验时,有以下步骤:①加入0.5 mL乙醛溶液;②加入2% 硫酸铜溶液4—5滴;③加入10% NaOH溶液2 mL;④加热至沸腾。其正确的操作顺序是
A.①②③④ B.③②①④
C.②③①④ D.①③②④
查看答案和解析>>
科目:高中化学 来源:2013-2014山西忻州一中、长治二中、临汾一中、康杰中学高三化学(解析版) 题型:简答题
(14分) CuCl是有机合成的重要催化剂,并用于颜料、防腐等工业。工业上由废铜料(含Fe、Al及其化合物、SiO2杂质),生产CuCl的工艺流程如下:

物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Cu(OH)2 | 5.6 | 6.7 |
Al(OH)3 | 3.8 | 4.7 |
已知:CuCl溶于NaCl的浓溶液可生成CuCl2-,CuCl2-的溶液用水稀释后可生成CuCl沉淀。
(1)煅烧的主要目的是: 。
(2)操作Ⅰ为调节溶液的PH值,范围为 ,加入的物质X可以是( )
A、CuO B、Cu(OH)2 C、NaOH 溶液 D、CaCO3
(3)滤渣Ⅱ的主要成分是 。
(4)往滤液Ⅱ中加入食盐并通入SO2可生成CuCl2-,请写出反应的离子方程式: 。
(5)在反应Ⅰ中,温度控制在70~80℃并使用浓NaCl溶液,主要目的是: 。
(6)常温下,已知CuOH的KSP为1.0×10-14,则Cu++H2O  CuOH + H+的平衡常数为: 。
CuOH + H+的平衡常数为: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com