
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Z在一定条件下可以电离 |
| B.Z的化学式可以表示为XY2 |
| C.X形成+2价阳离子 |
D.Z的电子式为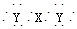 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.所有原子在同一平面 |
| B.分子中每个键的键长应相等 |
| C.在ABn中A原子没有孤对电子 |
| D.A的相对原子质量小于B |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.920 kJ | B.557 kJ | C.436 kJ | D.188 kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.反应①中反应物所具有的总能量大于生成物所具有的总能量 |
| B.2N2 H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1000.3 kJ/mol |
| C.铂作电极,KOH溶液作电解质溶液,由反应②设计的燃料电池,其负极反应式为N2H4-4e-+4OH-=N2+4H2O |
| D.铂作电极,KOH溶液作电解质溶液,由反应②设计的燃料电池,工作一段时间后,KOH溶液的pH将增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com