

| A、原子半径:W>Y>Z>M>X |
| B、X、Y、Z 三种元素形成的化合物中可能既有离子键又有共价键 |
| C、W分别与M、Z元素形成的化合物WM4、WZ2都是原子晶体 |
| D、X分别与Y、Z、M、W形成的常见化合物中,稳定性最好的是XM,沸点X2Z>XM |


科目:高中化学 来源: 题型:
| A、Wn+、Xm+、Ym-、Zn-的离子半径依次增大 |
| B、Y、Z的气态氢化物的热稳定性:YHm>HnZ |
| C、W、X、Y、Z的最高价氧化物对应的水化物都是强电解质 |
| D、W、X、Y、Z的最高价氧化物对应的水化物的碱性依次减弱,酸性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
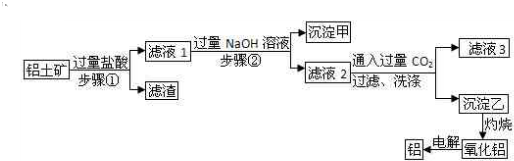
查看答案和解析>>
科目:高中化学 来源: 题型:
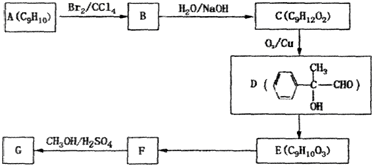
查看答案和解析>>
科目:高中化学 来源: 题型:
| W | X | ||
| Y | Z |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将饱和Na2SO4溶液加入到饱和石灰水中,有白色沉淀产生,说明Ksp[Ca(OH)2]大于Ksp[CaSO4] |
| B、Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关 |
| C、已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,该温度下反应Fe(OH)3+3H+?Fe3++3H2O的平衡常数K=4.0×104 |
| D、已知25℃时,Ksp[Mg(OH)2]=1.8×10-11,在MgCl2溶液中加入氨水,测得混合液的pH=11,则溶液中的c(Mg2+)为1.8×10-3mol.L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 光 |
| Br2 |
| NaOH,醇 |
| △ |
| Br水 |
| NaOH,H2O |
| O2,催化剂 |
| △ |
| O2,催化剂 |
| △ |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com