
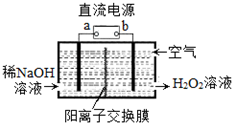
 H2O2是一种常用绿色氧化剂,工业上利用电解法制备H2O2的装置如图所示,初始溶液为氢氧化钠溶液:下列说法正确的是( )
H2O2是一种常用绿色氧化剂,工业上利用电解法制备H2O2的装置如图所示,初始溶液为氢氧化钠溶液:下列说法正确的是( )| A. | a为负极 | |
| B. | 通入空气的电极反应式为O2+2e-+2H+═H2O2 | |
| C. | 电解一段时间后,左侧溶液pH降低 | |
| D. | 若生成17g双氧水,则有1molH+从左侧向右侧迁移 |
分析 由题给信息可知,通入氧气在阴极还原得到H2O2,元素化合价降低,则b为负极,a为正极;与a相连的一极为阳极,与b极相连的一极为阴极,阳离子向阴极移动,根据两电极得失电子数相等进行计算.
解答 解:由题给信息氧气在阴极还原得到H2O2和稀碱的混合物,则b为负极,a为正极,阴极电极反应式为:O2+2e-+2H2O=H2O2+2OH-,
A、通入氧气在阴极还原得到H2O2,元素化合价降低,则a为正极,故A错误;
B、通入空气的电极发生还原反应,电极反应式为O2+2e-+2H2O=H2O2+2OH-,故B错误;
C、左侧氢氧根离子放电,生成水和氧气,氢氧根离子浓度降低,故左侧溶液pH降低,故C正确;
D、根据电极反应O2+2e-+2H2O=H2O2+2OH-,若生成17g双氧水,转移1mol电子,有1molNa+从左侧向右侧迁移,故D错误;
故选C.
点评 本题考查电解原理、得电子的一极发生还原反应,失去电子的一极发生氧化反应,根据元素化合价的变化情况进行判断正负极、阴阳极,根据得失电子守恒进行相关计算,侧重对学生综合能力的考查,需要学生具备扎实的基础,难度中等.


科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 名称 | 相对分 子质量 | 性状 | 熔点 | 沸点 | 密度 | 溶解度 | ||
| 水 | 乙醇 | 乙醚 | ||||||
| 甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 易溶 | 易溶 |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 | 易溶 |
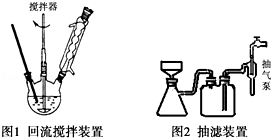
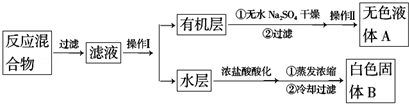
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A、B、C最简单氢化物的沸点依次递减,是因为A、B、C非金属性依次递减 | |
| B. | EB晶体是一种坚硬的高熔点材料,熔化时需克服离子键 | |
| C. | 在一定条件下,B的氧化物与B的简单氢化物均能反应生成单质B | |
| D. | C、D的常见氧化物均能溶于氢氧化钠溶液中,则C、D的氧化物均属于酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某温度下,1L pH=8的纯水中含OH-为10 -6mol | |
| B. | 电解精炼铜过程中,阳极质量的减少值与阴极质量的增加值一定相等 | |
| C. | 合成氨的反应是放热反应,则采用低温条件可以提高氨的生成速率 | |
| D. | CH3COOH溶液加水稀释后,溶液中$\frac{c(C{H}_{3}COOH)}{c(O{H}^{-})}$的值减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验操作 | |
| A | 验证淀粉已水解 | 在淀粉溶液中加入稀硫酸,水浴加热,一段时间后,再加入新制的银氨溶液并水浴加热 |
| B | 比较醋酸和次氯酸的酸性强弱 | 用PH试纸测定0.1mol•L-1醋酸钠溶液和0.01mol•L-1次氯酸钠溶液的PH |
| C | 证明Cl2的氧化性比Br2氧化性强 | 0.1mol•L-1 NaBr溶液中加入适量的新制氯水,反应后再加入适量的四氯化碳,振荡,观察下层液体的颜色 |
| D | 除去苯中混有的少量苯酚 | 向其中加入适量的溴水再过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+ | B. | SO42- | C. | Ba2+ | D. | Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | a点所示溶液中:c(H2R)+c(HR-)+c(R2-)=0.1mol•L-1 | |
| B. | b点所示溶液中:c(Na+)>c(HR-)>c(H2R)>c(R2-) | |
| C. | c点所示溶液中:c(Na+)<3c(R2-) | |
| D. | d点所示溶液中:c(Na+)>c(R2-)>c(HR-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com