
| A. | 铁与硫酸铜溶液反应:Fe+Cu2+═Fe2++Cu | |
| B. | 氢氧化钠溶液与稀盐酸反应:OH-+H+═H2O | |
| C. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 氯化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ |
分析 A.二者反应生成硫酸亚铁和铜;
B.二者反应生成氯化钠和水;
C.不符合反应客观事实;
D.二者反应实质为钡离子与硫酸根离子生成硫酸钡沉淀;
解答 解:A.铁与硫酸铜溶液反应,离子方程式:Fe+Cu2+═Fe2++Cu,故A正确;
B.氢氧化钠溶液与稀盐酸反应,离子方程式:OH-+H+═H2O,故B正确;
C.铁与稀硫酸反应生成硫酸亚铁和氢气,离子方程式:Fe+2H+═Fe2++H2↑,故C错误;
D.氯化钡溶液与稀硫酸反应,离子方程式:Ba2++SO42-═BaSO4↓,故D正确;
故选:C.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意离子反应遵循客观事实、遵循原子个数、电荷数守恒规律,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 4 | B. | 3 | C. | 3.5 | D. | 2.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
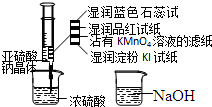 如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准).则下列有关说法正确的是( )
如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准).则下列有关说法正确的是( )| A. | 湿润淀粉碘化钾试纸未变蓝说明硫元素的非金属性强于碘元素 | |
| B. | 沾有KMnO4溶液的滤纸褪色证明了SO2具有漂白性 | |
| C. | 实验后,可把注射器中的物质缓缓推入NaOH溶液中,以减少环境污染 | |
| D. | 蓝色石蕊试纸变红说明SO2溶于水显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L SO3所含的分子数目为0.5NA | |
| B. | 1 molFe与过量的氯气反应,转移电子的数目为2 NA | |
| C. | 常温常压下,3.2 g O2和3.2 g O3所含氧原子数都是0.2NA | |
| D. | 50mL18.4mol•L-1的浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 反应物 | 加入物质 |
| ① | 10mL 2% H2O2溶液 | 无 |
| ② | 10mL 5% H2O2溶液 | 无 |
| ③ | 9mL 5% H2O2溶液 | 1mL 水 |
| ④ | 9mL 5% H2O2溶液 | 1mL 0.1mol•L-1 HCl溶液 |
| ⑤ | 9mL 5% H2O2溶液 | 1mL 0.1mol•L-1 NaOH溶液 |

| 物理量 实验序号 | V[30% H2O2]/mL | … | |
| 1 | a | … | |
| 2 | a | … |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com