
分析 (1)A管质量增加了2.16g为生成水的质量,B管增加了9.24g为生成二氧化碳的质量,根据质量守恒计算消耗氧气的质量;
(2)根据n=$\frac{m}{M}$计算二氧化碳、水、氧气的物质的量,根据原子守恒计算3.24g有机物中C、H、O原子物质的量,进而确定最简式,结合有机物的相对分子质量为108,进而确定分子式;
(3)该化合物遇FeCl3溶液显紫色,说明分子中含有酚羟基.
解答 解:(1)A管质量增加了2.16g为生成水的质量,B管增加了9.24g为生成二氧化碳的质量,根据质量守恒可知,消耗氧气的质量=2.16g+9.24g-3.24g=8.16g,
答:消耗氧气的质量是8.16g;
(2)2.16g水的物质的量=$\frac{2.16g}{18g/mol}$=0.12mol,n(H)=0.24mol,
9.24g二氧化碳的物质的量=$\frac{9.24g}{44g/mol}$=0.21mol,n(C)=0.21mol,
8.16g氧气的物质的量=$\frac{8.16g}{32g/mol}$=0.255mol,
3.24g有机物中n(O)=0.21mol×2+0.12mol-0.255mol×2=0.03mol,
3.24g有机物中C、H、O原子物质的量之比=0.21mol:0.24mol:0.03mol=7:8:1,
故该有机物最简式为C7H8O,
有机物的相对分子质量为108,而最简式C7H8O的式量=12×7+8+16=108,故最简式即为分子式,
即有机物分子式为:C7H8O,
答:该化合物的分子式为C7H8O;
(3)化合物的分子式为C7H8O,该化合物遇FeCl3溶液显紫色,说明分子中含有酚羟基,则结构简式为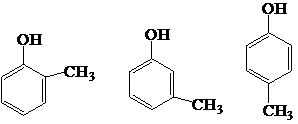 ,
,
答: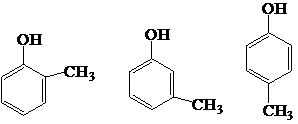 .
.
点评 本题考查有机物分子式确定、限制条件同分异构体的书写,题目难度中等,注意掌握确定有机物分子式、结构简式的方法,根据有机物燃烧产物的质量关系确定有机物的最简式为解答该题的关键.


科目:高中化学 来源: 题型:选择题
| A. |  属于芳香族化合物 属于芳香族化合物 | B. | 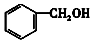 属于酚类化合物 属于酚类化合物 | ||
| C. | 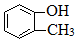 属于脂环化合物 属于脂环化合物 | D. | CH3 CH2CH(CH3)2属于链状化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
| 实验编号 | n(CO) | n(H2O) | n(H2) | n(CO2) |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 0.5 | 2 | 1 | 1 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用V(X)和V(Y)表示此反应的反应速率是:V(X)=V(Y)=(0.1-0.2a)mol•(L•min)-1 | |
| B. | 当混合气体的质量不再发生变化时,说明反应达到平衡状态,此时气体总量为(1+n)mol | |
| C. | 若建立平衡I的起始时n=1,维持温度和体积不变,向平衡I的体系中再加入cmolZ和dmolM[其中c>0的任意值,d≥(1-a)mol],达到平衡状态II,此时Y的体积分数一定为w% | |
| D. | 维持温度和体积不变,向上述平衡体系中再充入l mol X和n mol Y,此时v(正)增大,v(逆)减小,平衡正向移动,再次达到平衡时,Z的物质的量浓度为2a mol/L,M的物质的量为2a mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量是一个新的物理量,它表示的是物质的质量 | |
| B. | 周一上午升旗仪式时,学生和老师的物质的量共有2mol | |
| C. | 物质的量的单位是摩尔,简称摩,用mol表示 | |
| D. | 水的摩尔质量是18g |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:实验题
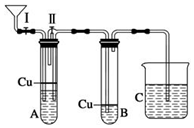 某化学课外兴趣小组为探究NO气体易被空气氧化,并观察NO气体的实际颜色,同时为了防止气体扩散污染空气,对实验室制取NO气体的装置改装如下:
某化学课外兴趣小组为探究NO气体易被空气氧化,并观察NO气体的实际颜色,同时为了防止气体扩散污染空气,对实验室制取NO气体的装置改装如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com