
【题目】下图为氯碱工业的简易装置示意图,其中两电极均为惰性电极,下列说法正确的是
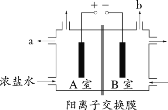
A.粗盐水中含有的少量 Ca2+和 Mg2+均可用 NaOH 除去
B.若电路中通过 0.2 mol 电子,理论上可在 b 处得到标准状况下 1.12 L 气体
C.a 处得到的是浓 NaOH 溶液
D.适当降低阳极电解液的 pH 有利于 Cl2 逸出
 天天向上一本好卷系列答案
天天向上一本好卷系列答案科目:高中化学 来源: 题型:
【题目】回答或解释下列问题:
(1)已知:P4(白磷,s) =4P(红磷,s) ΔH=-a kJ·mol-1(a>0),则稳定性:白磷_______红磷(填“大于”或“小于”)。
(2)在常温常压下,1 g 氢气在足量氯气中完全燃烧生成氯化氢气体,放出91.5 kJ 的热量。写出相应的热化学方程式为____________;
(3)将浓氨水滴入到固体氢氧化钠中,可以快速制备氨气,用平衡移动原理解释原因:____________;
(4)常温下,用0.1mol·L-1 NaOH溶液分别滴定20.00 mL 0.1mol/L HCl溶液和20.00 mL0.1 mol/L CH3COOH溶液,得到2条滴定曲线如图所示:

①由A、C点判断,滴定HCl溶液的曲线是__________(填“图1”或“图2”)。
②a=________ mL。
③D点对应离子浓度由大到小的顺序为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
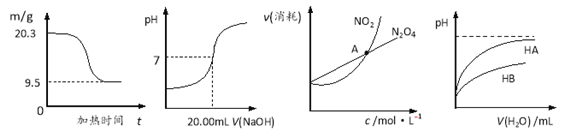
图1 图2 图3 图4
A. 图1表示0.1molMgCl2·6H2O在空气中充分加热时固体质量随时间的变化
B. 图2表示用0.1000 mol·LˉlNaOH溶液滴定25.00 mLCH3COOH的滴定曲线,则c(CH3COOH)=0.0800 mol·Lˉ1
C. 图3表示恒温恒容条件下,2NO2(g)![]() N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
D. 图4表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则常温下,NaA溶液的pH小于同浓度的NaB溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以氮气和水蒸气为原料,电化学合成氨装置(电极不参与反应)示意图如下。下列说法不正确的是

A.电极 a 连接电源的正极
B.OH向电极 a 迁移
C.总反应:2N2+6H2O(g)![]() 4NH3+3O2
4NH3+3O2
D.电极 b 的电极反应:N2+6e+6H+==2NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10 mol/L的NaOH溶液分别滴定体积均为50.00 mL、浓度均为0.05 mol/L的HClO、HF两种溶液,其滴定曲线如图所示。

下列说法正确的是
A.HClO的酸性比HF强
B.V(NaOH)=0mL时,对应溶液中:c(ClO-)=c(F-)
C.V(NaOH)=12.50mL时,对应溶液中:c(ClO-)>c(F-)
D.V(NaOH)=25.00mL时,对应溶液中:c(ClO-)<c(F-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。
① 醋酸在水溶液中的电离方程式为_______________________________。
② 下列方法中,可以使醋酸稀溶液中 CH3COOH 电离程度增大的是_______________________________(填字母序 号)。
a.滴加少量浓盐酸 b.微热溶液
c.加水稀释 d.加入少量醋酸钠晶体
(2)Ⅰ.两种酸均能与氢氧化钠反应生成盐,其中醋酸与氢氧化钠反应能生成醋酸钠。实验室现有醋酸钠固体,取少量溶于水,溶液呈_______________________________(选填“酸性”、“中性”或“碱性”),其原因是(用离子方程式表示)_______________________________。
Ⅱ.用 0.1 mol·L-1 NaOH 溶液分别滴定体积均为 20.00 mL、浓度均为 0.1 mol·L-1 的盐酸和醋酸溶液,得到滴定过程中溶液 pH 随加入 NaOH 溶液体积而变化的两条滴定曲线。
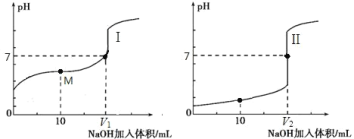
①滴定醋酸的曲线是_______________________________(填“I”或“II”)。
② 滴定开始前,三种溶液中由水电离出的 c(H+)最大的是_______________________________。
③ V1 和 V2 的关系:V1_______________________________V2(填“>”、“=”或“<”)。
④ M 点对应的溶液中,各离子的物质的量浓度由大到小的顺序是_______________________________。
(3)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。 资料:AgSCN 是白色沉淀,相同温度下,溶解度:AgSCN > AgI。
操作步骤 | 现象 |
步骤 1:向 2 mL 0.005 mol·L-1 AgNO3 溶液中加入 2 mL 0.005 mol·L-1 KSCN 溶液,静置。 | 出现白色沉淀。 |
步骤 2:取 1 mL 上层清液于试管中,滴加 1 滴 2 mol·L-1Fe(NO3)3 溶液。 | 溶液变红色。 |
步骤 3:向步骤 2 的溶液中,继续加入 5 滴 3 mol·L-1 AgNO3溶液。 | 现象 a ,溶液红色变浅。 |
步骤 4:向步骤 1 余下的浊液中加入 5 滴 3 mol·L-1 KI 溶液。 | 白色沉淀转化成黄色沉淀。 |
① 写出步骤 2 中溶液变红色的离子方程式_____。
② 步骤 3 中现象 a 是_____。
③ 用化学平衡原理解释步骤 4 的实验现象_____。
(4)某小组模拟工业上回收分银渣中的银,过程如下:
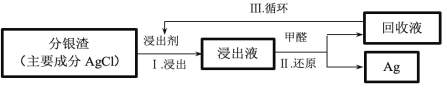
过程 I 的主要反应:AgCl+2![]()
![]()
![]() +Cl-
+Cl-
过程 II 的离子反应:4![]() +6OH- +HCHO=4Ag++8
+6OH- +HCHO=4Ag++8![]() +4H2O+
+4H2O+![]()
Ⅲ中回收液可直接循环使用,但循环多次后,I 中的银的浸出率会降低。从回收液离子浓度变化和反应限度的角度分析原因:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是甲醇燃料电池的结构示意图。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为2CH3OH +3O2![]() 2CO2+ 4H2O。下列说法不正确的是
2CO2+ 4H2O。下列说法不正确的是

A.左电极为电池的负极,a处通入的物质是甲醇
B.正极反应式为:O2+ 2H2O + 4e-= 4OH-
C.负极反应式为:CH3OH + H2O-6e- = CO2+ 6H+
D.该电池提供1mole-,消耗氧气0.25mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现需设计一套实验装置来电解饱和食盐水,并测量电解产生的氢气的体积(约6 mL)和检验氯气的氧化性(不应将多余的氯气排入空气中)。

(1)试从上图图1中选用几种必要的仪器,连成一整套装置,各种仪器接口的连接顺序(填编号)是:A接______,B接______。
(2)碳棒上发生的电极反应为_______。
(3)能说明氯气具有氧化性的实验现象是_______。
(4)假定装入的饱和食盐水为50 mL(电解前后溶液体积变化可忽略),当测得的氢气为5.6 mL(已折算成标准状况)时,溶液的pH为____。
(5)工业上采用离子交换膜法电解饱和食盐水,如上图图2,该离子交换膜是__(填“阳离子”或“阴离子”)交换膜,溶液A是_______(填溶质的化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白藜芦醇广泛存在于食物(例如桑甚、花生,尤其是葡萄)中,它可能具有抗癌性。能够与1 mol该化合物发生反应的Br2和H2的最大用量分别是( )

A.1mol、1molB.3.5mol、7mol
C.3.5mol、6molD.6mol、7mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com