
| 阳离子 | K+、Cu2+、Fe3+、Al3+、Fe2+ |
| 阴离子 | Cl-、CO32-、NO3-、SO42-、SiO32- |
分析 Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察),说明没有K+,
Ⅱ.取少量原溶液,加入KSCN溶液无明显变化,说明没有Fe3+;
Ⅲ.另取原溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,说明含有NO3-且有还原性离子Fe2+,则一定没有碳酸根离子和硅酸根离子,且溶液中阴离子种类不变,说明含有Cl-;
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成,说明含有SO42-;据此分析.
解答 解:(1)用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察),说明没有K+,取少量原溶液,加入KSCN溶液无明显变化,说明没有Fe3+;
故答案为:K+、Fe3+;
(2)若向原溶液中加入稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,说明Fe2+与NO3-和H+反应生成NO,亚铁离子与稀硝酸反应生成硝酸铁和一氧化氮和水,故离子反应方程式为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,故答案为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
(3)NO能够与水反应生成一氧化氮和硝酸,化学方程式为3NO2+H2O=2HNO3+NO,故答案为:3NO2+H2O=2HNO3+NO;
(4)溶液中有Fe2+、NO3-,故不能含有SiO32-和CO32-,加盐酸溶液中阴离子种类不变,说明原溶液中有Cl-;故依据电荷守恒得出:溶液中负电荷总浓度为:0.1+0.1+0.1×2=0.4mol,正电荷总浓度为:0.1×2,故溶液中还含有0.1mol的Mg2+,故5种离子可以确定为:Cl-、NO3-、SO42-、Fe2+、Mg2+,故答案为:Fe2+、Mg2+;Cl-、NO3-、SO42-;
(5)加入足量的氢氧化钠后,发生反应生成Fe(OH)2和Mg(OH)2,氢氧化亚铁不稳定易被氧化为氢氧化铁,充分反应后过滤,洗涤,灼烧沉淀至恒重,最终得到的固体为Fe2O3和MgO,依据元素守恒得出Fe2O3为0.1mol/L×0.05L×$\frac{1}{2}$=0.0025mol,故质量为:0.0025mol×120g/mol=0.3g;MgO的物质的量为0.005mol,质量为:0.005mol×60g/mol=0.3g,故固体的总质量为0.6g,故答案为:0.6.
点评 本题考查离子共存与推断等,是对学生综合能力的考查,关键是明确常见离子检验与离子间发生的反应,题目难度中等.


科目:高中化学 来源: 题型:选择题
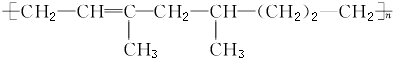
| A. | 该高聚物是通过加聚反应生成的 | |
| B. | 合成该高聚物的单体有三种 | |
| C. | 1 mol该物质能与1 mol H2加成,生成不含碳碳双键的物质 | |
| D. | 该高聚物能被酸性KMnO4溶液氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | N2、H2、NH3的百分含量相等 | |
| B. | 单位时间,消耗a mol N2的同时消耗3mol H2 | |
| C. | 单位时间,消耗a molN2的同时生成3a mol H2 | |
| D. | 反应若在定容的密器中进行,温度一定时,压强不随时间改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K1=-K2 | B. | K1=K2 | C. | K1=$\frac{1}{{K}_{2}}$ | D. | K1=$\frac{1}{2}$K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 目前工业废气脱硫应用最广泛的方法是石灰法 | |
| B. | 工业上通过电解熔融的MgCl2获得金属Mg | |
| C. | 钠是一种强还原剂,可以把钛、锆、铌等从其熔融盐中置换出来 | |
| D. | 高炉炼铁的主要反应原理是碳在高温下直接将氧化铁还原成铁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com