
科目:高中化学 来源:2015-2016学年内蒙古平煤高中高一实验班下期中化学卷(解析版) 题型:填空题
甲烷燃料电池电解质溶液:稀硫酸溶液。
电池总反应:CH4+2O2=CO2+2H2O
负极通入的气体是______正极通入的气体是______;
负极反应:___________;
正极反应:_______________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁庄河高中高一下期中化学试卷(解析版) 题型:选择题
可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极。下列说法正确的是( )
A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-=4OH-
B.以NaOH溶液为电解液时,负极反应为:Al+3OH--3e-=Al(OH)3↓
C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变
D.电池工作时,电子通过外电路从正极流向负极
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽六安一中高一下周末作业四化学试卷(解析版) 题型:选择题
下图是将SO2转化为重要的化工原料H2SO4的原理示意图,下列说法不正确的是
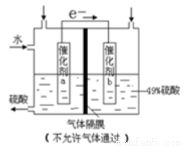
A.该装置将化学能转化为电能,电流方向为b a
a
B.催化剂b表面O2发生还原反应,其附近酸性增强
C.催化剂a表面的反应是:SO2+2H2O-2e-=SO42-+4H+
D.若得到的硫酸浓度仍为49%,则理论上参加反应的SO2与加入的H2O的质量比为8:15
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽六安一中高一下周末作业四化学试卷(解析版) 题型:选择题
航天飞机用铝粉与高氯酸铵(NH4ClO4)的混合物为固体燃料,点燃时铝粉氧化引发高氯酸铵反应,其方程式可表示为:2NH4ClO4=N2↑+4H2O+Cl2↑+2O2↑;△H<0 下列对此反应的叙述中错误的是
A.上述反应属于分解反应
B.上述反应瞬间产生大量高温气体推动航天飞机飞行
C.反应从能量变化上说,主要是化学能转变为热能和动能
D.在反应中高氯酸铵只能起氧化剂作用
查看答案和解析>>
科目:高中化学 来源:2016年全国普通高等学校招生统一考试化学(浙江卷参考版) 题型:选择题
为落实“五水共治”,某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
下列说法不正确的是
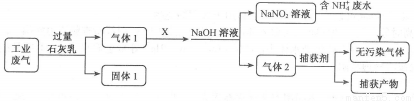
A.固体1中主要含有Ca(OH)2、CaCO3、CaSO3
B.X可以是空气,且需过量
C.捕获剂所捕获的气体主要是CO
D.处理含NH4+废水时,发生反应的离子方程式为:NH4++NO2-==N2↑+2H2O
查看答案和解析>>
科目:高中化学 来源:2016年全国普通高等学校招生统一考试化学(江苏卷参考版) 题型:实验题
[实验化学]
焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中、受热时均易分解。实验室制备少量Na2S2O5的方法:在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2,实验装置如下图所示。
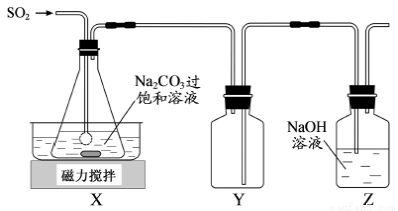
当溶液pH约为4时,停止反应,在20℃左右静置结晶。生成Na2S2O5的化学方程式为2NaHSO3===Na2S2O5+H2O
(1)SO2与Na2CO3溶液反应生成NaHSO3和CO2,其离子方程式为____________________。
(2)装置Y的作用是______________________________。
(3)析出固体的反应液经减压抽滤、洗涤、25℃~30℃干燥,可获得Na2S2O5固体。
①组成减压抽滤装置的主要仪器是布氏漏斗、________________和抽气泵。
②依次用饱和SO2水溶液、无水乙醇洗涤Na2S2O5固体。用饱和SO2水溶液洗涤的目的是______。
(4)实验制得的Na2S2O5固体中含有一定量的Na2SO3和Na2SO4,其可能的原因是______。
查看答案和解析>>
科目:高中化学 来源:2016年全国普通高等学校招生统一考试化学(江苏卷参考版) 题型:选择题
下列指定反应的离子方程式正确的是
A.将铜插入稀硝酸中:Cu+4H++2NO3 -=Cu2++2NO2↑+H2O
B.向Fe2(SO4)3溶液中加入过量铁粉:Fe3++Fe=2Fe3+
C.向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3﹒H2O=Al(OH)3↓+3NH4+
D.向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+=H2SiO3↓+3Na+
查看答案和解析>>
科目:高中化学 来源:2016年全国普通高等学校招生统一考试化学(全国2卷参考版) 题型:简答题
[化学-选修2:化学与技术]
双氧水是一种重要的氧化剂、漂白剂和消毒剂。生产双氧水常采用蒽醌法,其反应原理和生产流程如图所示:
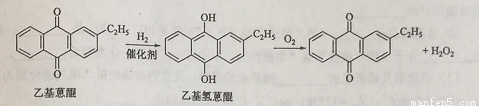
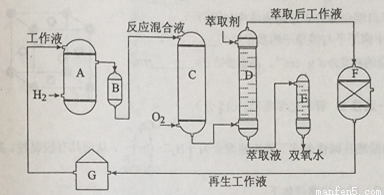
A.氢化釜B.过滤器C.氧化塔D.萃取塔E.净化塔F.工作液再生装置G.工作液配制装置
生产过程中,把乙基蒽醌溶于有机溶剂配制成工作液,在一定的温度、压力和催化剂作用下进行氢化,再经氧化、萃取、净化等工艺得到双氧水。回答下列问题:
(1)蒽醌法制备双氧水理论上消耗的原料是_______,循环使用的|原料是______,配制工作液时采用有机溶剂而不采用水的原因是______。
(2)氢化釜A中反应的化学方程式为_______,进入氧化塔C的反应混合液中的主要溶质为_______。
(3)萃取塔D中的萃取剂是____,选择其作萃取剂的原因是______。
(4)工作液再生装置F中要除净残留的H2O2,原因是______。
(5)双氧水浓度可在酸性条件下用KMnO4溶液测定,该反应的离子方程式为_______。一种双氧水的质量分数为27.5%,(密度为1.10g·cm3),其浓度为______mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com