
对反应A+BAB来说,常温下按以下情况进行反应:
①20 mL溶液中含A、B各0.01 mol ②50 mL溶液中含A、B各0.05 mol ③0.1 mol·L-1的A、B溶液各10 mL④0.5 mol·L-1的A、B溶液各50 mL
四者反应速率的大小关系是( )
A.②>①>④>③ B.④>③>②>①
C.①>②>④>③ D.①>②>③>④
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:
已知25 ℃时BaSO4饱和溶液中存在BaSO4(s)Ba2+(aq)+SO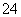 (aq),Ksp=1.102 5×10-10,向c(SO
(aq),Ksp=1.102 5×10-10,向c(SO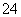 )为1.05×10-5 mol·L-1的BaSO4溶液中加入BaSO4固体,SO
)为1.05×10-5 mol·L-1的BaSO4溶液中加入BaSO4固体,SO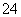 的浓度怎样变化?试通过计算说明。
的浓度怎样变化?试通过计算说明。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列晶体熔沸点由高到低的顺序正确的是( )
①SiC ②Si ③HCl ④HBr ⑤HI ⑥CO ⑦N2 ⑧H2
A.①②③④⑤⑥⑦⑧ B.①②⑤④③⑥⑦⑧
C.①②⑤④③⑦⑥⑧ D.⑥⑤④③②①⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
氯化亚铜(CuCl)为白色晶体,微溶于水,能溶于氨水、浓盐酸,并生成配合物,不溶于硫酸、稀硝酸和醇,在工业上应用广泛。工业上制取氯化亚铜的工艺流程如下:

实验药品:铜丝20 g、氯化铵20 g、65%硝酸10 mL、36%盐酸15 mL、水。
(1)反应①的化学方程式为________________________________________________,
用95%乙醇代替蒸馏水洗涤的主要目的是____________________________________________
________________________________________________________________________(写出一条即可)。

(2)工业化生产时,95%乙醇可通过__________的方法回收并循环利用,而NH4Cl、____________(填化学式)可直接循环利用。
(3)实验室用右图装置制备CuCl。
①实验时通入O2的速率不宜过大,为便于观察和控制产生O2的速率,最宜选择下列装置中的________(填字母)。
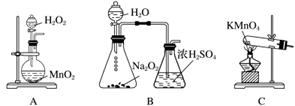
②实验开始时,温度计显示反应液温度低于室温,主要原因是________________________________________________________________________
________________________________________________________________________。
电炉加热升温至50 ℃时停止加热,反应快速进行,烧瓶上方气体颜色逐渐由无色变为红棕色,从环保角度考虑,当______________________________时才能停止通入氧
气;待冷却至室温后,再打开瓶塞,沿________(填字母)口倾出棕色反应液于1 000 mL大烧杯中,加水500 mL,即有大量白色沉淀析出。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭容器中充入一定量的N2和O2,在电火花作用下发生反应N2+O2===2NO,经测定前3 s用N2表示的反应速率为0.1 mol·L-1·s-1,则6 s末NO的浓度为
A.1.2 mol·L-1 B.大于1.2 mol·L-1
C.小于1.2 mol·L-1 D.不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案。
| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度℃ | ||
| 浓度/(mol·L-1) | 体积/mL | 浓度/(mol·L-1) | 体积/mL | ||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4溶液转化为MnSO4,每消耗1 mol H2C2O4转移________mol电子。为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4)∶n(KMnO4)≥__________________________。
(2)探究温度对化学反应速率影响的实验编号是________(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是____________。
(3)实验①测得KMnO4溶液的褪色时间为40 s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率

v(KMnO4)=________
mol·L-1·min-1。
(4)已知50 ℃时c(MnO )~反应时间t的变化曲线如图。若保持其他条件不变,请在坐标图中,画出25 ℃时c(MnO
)~反应时间t的变化曲线如图。若保持其他条件不变,请在坐标图中,画出25 ℃时c(MnO )~t的变化曲线示意图。
)~t的变化曲线示意图。
查看答案和解析>>
科目:高中化学 来源: 题型:
H2O2是一种绿色氧化还原试剂,在化学研究中应用广泛。
某小组拟在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响。限选试剂与仪器:30%H2O2,0.1 mol·L-1Fe2(SO4)3、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器。

①写出本实验H2O2分解反应方程式并标明电子转移的方向和数目:________________________________________________________________________。
②设计实验方案:在不同H2O2浓度下,测定________________(要求所测得的数据能直接体现反应速率大小)。
③设计实验装置,完成上图的装置示意图。
④参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据;数据用字母表示)。
| 物理量 实验序号 | V[0.1 mol·L-1 Fe2(SO4)3]/mL | …… | |
| 1 | a | …… | |
| 2 | a | …… |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法错误的是( )
A.可利用废油脂制肥皂
B.袋装食品常用生石灰包作为食品的抗氧化剂
C.配制CuSO4溶液时加入少量的稀硫酸
D.用钠和钠的化合物做焰色反应实验,焰色均为黄色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com