
分析 (1)根据n=cV计算出盐酸中含有HCl的物质的量,根据n=$\frac{V}{{V}_{m}}$计算出生成氢气的物质的量,据此判断盐酸是否过量,然后分别根据合金总质量、生成氢气的量列式计算;
(2)根据氢元素守恒计算出消耗HCl的物质的量,再根据V=$\frac{n}{c}$计算出消耗盐酸的体积;
(3)沉淀达到最大时溶液中溶质为NaCl,根据n(NaOH)=n(NaCl)=n(HCl)计算出消耗氢氧化钠的物质的量,再根据V=$\frac{n}{c}$计算出需要加入氢氧化钠溶液的体积;
(4)再加入NaOH溶液至足量,氢氧化铝溶解,最后剩余的沉淀是氢氧化镁,根据镁元素守恒计算出氢氧化镁的质量.
解答 解:(1)1L 5mol/L的盐酸中含有HCl的物质的量为:5mol/L×1L=5mol,标准状况下22.4L氢气的物质的量为:$\frac{22.4L}{22.4L/mol}$=1mol,生成1mol氢气消耗2molHCl,说明盐酸过量,设合金中含有Mg、Al的物质的量分别为x、y,则:24x+27y=21、x+1.5y=1,联立解得:x=0.5mol、y=$\frac{1}{3}$mol,
则合金中含有镁的质量为:24g/mol×0.5mol=12g,含有铝的质量为:27g/mol×$\frac{1}{3}$mol=9g,
故答案为:12g;9g;
(2)生成1mol氢气需要消耗2molHCl,则反应中共消耗5mol/L的盐酸的体积为:$\frac{2mol}{5mol/L}$=0.4L=400mL,
故答案为:400;
(3)向反应后的溶液中逐滴加入5mol/L的NaOH溶液,若要使沉淀恰好达到最大值时溶液中溶质为NaCl,根据质量守恒可得:n(NaOH)=n(NaCl)=n(HCl)=5mol,则需要加入NaOH的体积为:$\frac{5mol}{5mol/L}$=1L,
故答案为:1;
(4)再加入NaOH溶液至足量,氢氧化铝溶解,则最后剩余的沉淀是氢氧化镁,根据质量守恒定律可知生成氢氧化镁的物质的量为0.5mol,质量为:58g/mol×0.5mol=29g,
故答案为:氢氧化镁;29.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的原理为解答关键,注意掌握守恒思想在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | ①中的I2为固态,②中的I2为气态 | |
| B. | ②的反应物总能量比①的反应物总能量低 | |
| C. | ①的产物比②的产物热稳定性更好 | |
| D. | 1 mol固态碘升华时将吸热17 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 6 g氧气和臭氧(O3)的混合气所含的原子数目为NA | |
| B. | 含有NA个氦原子的氦气在标准状况下的体积约为11.2L | |
| C. | 在标准状况下,22.4 L水含有1mol 水分子 | |
| D. | 22 gCO2与标准状况下11.2 L HCl含有相同的原子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0×10-3mol/L盐酸的pH=3.0,1.0×10-8mol/L盐酸的pH=8.0 | |
| B. | 在醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b | |
| C. | 在滴有酚酞溶液的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7 | |
| D. | 常温若1mLpH=1的盐酸与100mLNaOH溶液混合后,溶液的pH=7则NaOH溶液的pH=11 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
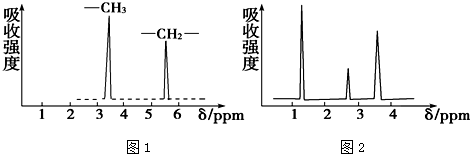
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com