
 ,故答案为:
,故答案为: .
.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
| A、p (Ne)<p (H2)<p (O2) |
| B、p (O2)<p (Ne)<p (H2) |
| C、p (H2)<p (O2)<p (Ne) |
| D、p (H2)<p (Ne)<p (O2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
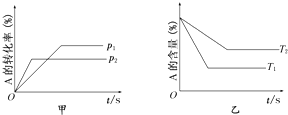
| A、p1<p2 T1>T2 |
| B、减小压强,正逆反应速率都减小,平衡右移 |
| C、△H>0△S>0 |
| D、升高温度,混合气体的平均摩尔质量增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NA |
| B、2NA |
| C、3NA |
| D、4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、焰色反应为化学变化 |
| B、所有金属及其化合物灼烧时火焰均有颜色 |
| C、NaCl与Na2CO3灼烧时火焰颜色相同 |
| D、焰色反应均应透过蓝色钴玻璃观察 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 “神七”登天标志着我国的航天事业进入了新的篇章.
“神七”登天标志着我国的航天事业进入了新的篇章.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
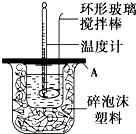 分别取40mL的0.50mol/L盐酸与0.55mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题:
分别取40mL的0.50mol/L盐酸与0.55mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题:| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
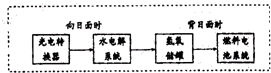
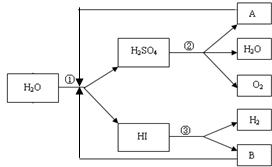 人类研究氢能源从未间断过,而热化学循环分解水制氢气是在水反应体系中加入一种中间物,经历不同的反应阶段,最终将水分解为氢气和氧气,这是一种节约能源、节省反应物料的技术,如图是一个热化学循环制氢气法的流程:
人类研究氢能源从未间断过,而热化学循环分解水制氢气是在水反应体系中加入一种中间物,经历不同的反应阶段,最终将水分解为氢气和氧气,这是一种节约能源、节省反应物料的技术,如图是一个热化学循环制氢气法的流程:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com