
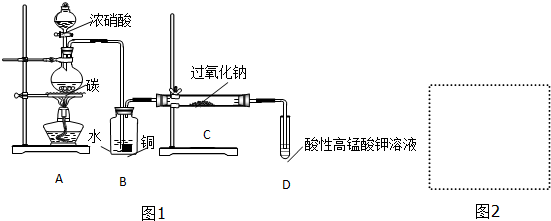
 .
.| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
分析 (1)碳与浓硝酸在加热条件下反应生成二氧化碳、二氧化氮和水,据此写出方程式,根据化合价变化标出电子转移的方向和数目;
(2)装置C中需要用NO和过氧化钠反应,则装置B是用于提供NO气体;
(3)通过B装置的气体中含有二氧化碳、NO和水,需要将二氧化碳和水除去,据此选用试剂,并画出装置图;
(4)酸性KMnO4溶液可将NO2-氧化为NO3-,MnO4-还原成Mn2+,据此设计实验方案检验装置C中NaNO2的存在;
(5)第一组实验数据消耗的酸性高锰酸钾溶液体积偏大,
A.酸式滴定管用蒸馏水洗净后未用标准液润洗,导致标准液被稀释,标准液浓度减小;
B.达到过程中锥形瓶不需要干燥,不影响待测液中溶质的物质的量;
C.滴定终了仰视读数,读出的是凹液面下方读数,读数比实际消耗的标准液体积偏大;
D.滴定终了俯视读数,读出的是凹液面上方读数,读数比实际读数偏小;
(6)第一组数据舍弃,计算出其它3组消耗标准液的平均体积,再结合反应方程式计算出样品中亚硝酸钠的质量及质量分数.
解答 解:(1)装置A中C与浓硝酸反应的化学方程式的方程式为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,反应中电子转移数目为4,标出电子转移的方向和数目为: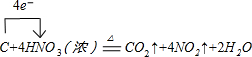 ,故答案为:
,故答案为: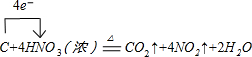 ;
;
(2)根据实验装置可知,装置C中发生反应:2NO+Na2O2=2NaNO2,则装置B的作用是将NO2转化为NO,同时Cu与稀硝酸反应生成NO(或制取NO),
故答案为:将NO2转化为NO,同时Cu与稀硝酸反应生成NO(或制取NO);
(3)为制备纯净NaNO2,需要将进入装置C的气体中的二氧化碳和水除去,碱石灰能够吸收二氧化碳和水,故可以选用碱石灰,装置图如: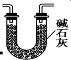 或
或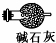 ,
,
故答案为: 或
或 ;
;
(4)根据题中信息可知,酸性KMnO4溶液可将NO2-氧化为NO3-,MnO4-还原成Mn2+,据此可设计出检验亚硝酸钠的方法为:取少量装置C中产物置于试管中,加入适量蒸馏水溶解,(加入稀硫酸酸化)滴加入1-2滴(少量)酸性KMnO4溶液,若溶液紫色褪去,说明C中产物含有NaNO2,
故答案为:取少量装置C中产物置于试管中,加入适量蒸馏水溶解,(加入稀硫酸酸化)滴加入1-2滴(少量)酸性KMnO4溶液,若溶液紫色褪去,说明C中产物含有NaNO2;
(5)第一组实验数据消耗的酸性高锰酸钾溶液体积偏大,会导致测量结果偏高,
A.酸式滴定管用蒸馏水洗净后未用标准液润洗,导致标准液被稀释,滴定过程中消耗的标准液体积会偏大,故A正确;
B.锥形瓶不需要干燥,所以锥形瓶洗净后未干燥,不影响测定结果,故B错误;
C.滴定终了仰视读数,导致读数偏大,计算出的标准液体积偏大,故C正确;
D.滴定终了俯视读数,滴定管读数偏小,计算出的标准液体积偏小,故D错误;
故答案为:AC;
(6)由于第一组数据偏高,应该舍弃;其它三组消耗标准液平均体积为:$\frac{20.02+20.00+19.98}{3}$mL=20.00mL,
25mL样品消耗高锰酸钾的物质的量为:0.1000mol/L×0.02L=0.002mol,则250mL样品溶液会消耗高锰酸钾的物质的量为:0.002mol×$\frac{250mL}{25mL}$=0.02mol,根据化合价变化可得反应关系式:2MnO4-~5NO2-,则4.000g样品中含有亚硝酸钠的物质的量为:0.02mol×$\frac{5}{2}$=0.05mol,质量为69g/mol×0.05mol=3.45g,所以反应后的固体中亚硝酸钠的质量分数为:$\frac{3.45g}{4.000g}$×100%=86.25%,
故答案为:86.25%或0.8625.
点评 本题考查了探究物质组成、测量物质含量的方法,题目难度较大,涉及性质实验方案的设计、中和滴定操作及误差分析、氧化还原反应中电子转移的分析、化学计算等知识,明确实验原理及化学实验基本操作方法为解答关键,试题培养了学生的分析、理解能力及化学实验、化学计算能力.


科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 0.5mol•L-1 NH4NO3溶液中含氮原子数目6.02×1023 | |
| B. | 标准状况下,22.4L C3H8含有C-H键的数目为6.02×1023 | |
| C. | 32g SO2与足量O2混合充分反应,转移的电子数目为6.02×1023 | |
| D. | 常温下,500mL pH=0的硫酸溶液中含有的H+数目为6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氢是一种重要的非金属元素.氢的单质及其化合物在科学研究和工业生产中有着广泛而重要的作用.
氢是一种重要的非金属元素.氢的单质及其化合物在科学研究和工业生产中有着广泛而重要的作用.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 操作1:准确称取一定质量的胆矾晶体并用适量蒸馏水溶解. 操作2:将所得溶液转移到仪器X中,用蒸馏水冲洗烧杯和玻璃棒2~3次,将洗涤液也转移到X中. 操作3:继续向X中加蒸馏水至液面 离X的刻度线l~2cm处. |

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | b-a=n+m | B. | a-b=n+m | C. | 核电荷数X>Y | D. | 质子数Y>X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 25℃时0.1mol/L的硫化钠含S组份φ%(以物质的量计算)分布如图如下,下列结论正确的是( )
25℃时0.1mol/L的硫化钠含S组份φ%(以物质的量计算)分布如图如下,下列结论正确的是( )| A. | 当c(HS-)>c(S2-)时,溶液一定显酸性 | |
| B. | 当pH=7时,溶液中有c(Na+)=c(HS-)+2c(S2-)+c(H2S) | |
| C. | 当4<pH时,向其中滴加0.1mol/LCuSO4都有CuS沉淀(Ksp(CuS)=6.3×10-36) | |
| D. | 当pH=9时,溶液中有c(H+)=c(OH-)+c(HS-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com