
| 离子 | 浓度mol•L-1 | 离子 | 浓度mol•L-1 |
| Na+ | 0.1 | Cl- | 0.9 |
| Ag+ | 0.5 | NO3- | 0.3 |
| Mg2+ | 0.3 |
| 离子 | 浓度mol•L-1 | 离子 | 浓度mol•L-1 |
| Na+ | 0.1 | Cu2+ | 0.2 |
| Ba2+ | 0.5 | NO3- | 1.5 |
| Mg2+ | 0.3 | Cl- | 0.6 |
| 离子 | 浓度mol•L-1 | 离子 | 浓度mol•L-1 |
| Na+ | 0.1 | Cl- | 0.2 |
| K+ | 0.5 | NO3- | 0.3 |
| Mg2+ | 0.3 | SO42- | 0.4 |
分析 溶液(1)中离子之间结合生成沉淀;
(2)中Cu2+为蓝色,与无色不符;
(3)中离子之间不反应,但溶液为电中性,以此来解答.
解答 解:溶液(1)结果是不可靠,理由为Ag+和Cl-不能共存;
溶液(2)结果是不可靠,理由为原溶液为无色,不可能有Cu2+;
溶液(3)结果是不可靠,由电荷可知,0.1+0.5+0.3×2≠0.2+0.3+0.4×2,则理由为溶液中阴阳离子电荷不平衡,
故答案为:不可靠;Ag+和Cl-不能共存;不可靠;原溶液为无色,不可能有Cu2+;不可靠;溶液中阴阳离子电荷不平衡.
点评 本题考查离子的共存,为高频考点,把握常见离子之间的反应、电荷守恒、离子的颜色为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 原子序数依次增大的A、B、C、D、E、F六种元素.其中A的基态原子有3个不同能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E,F和C位于同一主族,F处于第一个长周期.
原子序数依次增大的A、B、C、D、E、F六种元素.其中A的基态原子有3个不同能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E,F和C位于同一主族,F处于第一个长周期.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
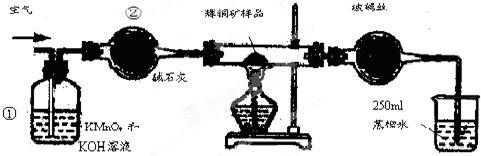
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.04 | 21.03 |
| 2 | 25.00 | 1.98 | 21.99 |
| 3 | 25.00 | 3.20 | 21.24 |
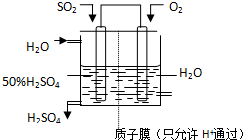
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1Na2S溶液中含有0.2NA个Na+ | |
| B. | 标准状况下,22.4L的H2O含有2NA个氢原子 | |
| C. | 常温下,44gCO2含有NA个氧原子 | |
| D. | 0.1molNa与足量O2反应生成Na2O,转移0.1NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
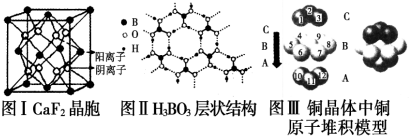
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
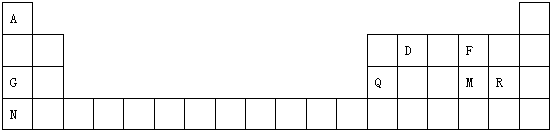
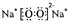 ,该物质含有的化学键的类型是离子键、非极性共价键 .
,该物质含有的化学键的类型是离子键、非极性共价键 .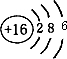 .
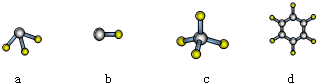
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
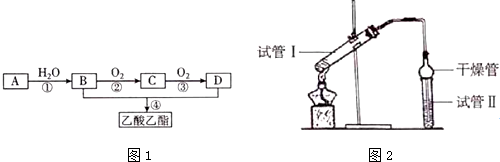
| 实验编号 | 试管I中试剂 | 试管Ⅱ中有机层的厚度/cm |
| A | 3mL乙醇、2mL乙酸、2mL 18mol•L-1浓硫酸 | 3.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 |
| C | 3mL 乙醇、2mL 乙酸 2mL3mol•L-1H2SO4 | 0.6 |
| D | 3mL乙醇、2mL乙酸、盐酸 | 0.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com