
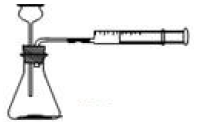
 甲同学用0.1×10×25mm、质量分数≥99.5%的铝片和盐酸用下图装置反应制取H2,实验现象如表:
甲同学用0.1×10×25mm、质量分数≥99.5%的铝片和盐酸用下图装置反应制取H2,实验现象如表: | 1min | 2min | 5min | 15min | 20min |
| 3mol•L-1HCl | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 铝片耗尽 |
分析 (1)在金属活动顺序表中,铝排在氢的前面,铝与非强氧化性酸中的氢离子反应生成铝离子和氢气;
(2)实验开始1min内反应速率很慢,原因是温度低,铝片表面的三氧化二铝先和盐酸反应没有气体生成;
(3)温度越高反应速率越快,金属和酸的反应是放热反应;
(4)据C=$\frac{n}{v}$进行计算;V=$\frac{△C}{△t}$进行计算;
(5)据接触面积越大,化学反应速率越快来分析;
(6)根据化学反应前后元素守恒分析杂质.
解答 解:(1)盐酸、稀硫酸为非强氧化性的酸,铝与酸反应生成铝离子和氢气,离子方程式为:2Al+6H+=2Al3++3H2↑,
故答案为:2Al+6H+=2Al3++3H2↑;
(2)实验开始1min内反应速率很慢,原因是温度低,铝片表面的三氧化二铝先和盐酸反应没有气体生成,
故答案为:温度低,铝片表面的三氧化二铝先和盐酸反应没有气体生成;
(3)反应1~15min内,铝与酸的反应是放出热量的,导致温度升高,使化学反应速率加快,
故答案为:反应放热,温度升高;
(4)n(H2)=$\frac{v}{{V}_{m}}$=$\frac{0.448L}{22.4L/mol}$=0.02mol,c(H2)=$\frac{n({H}_{2})}{V}$=$\frac{0.02mol}{0.448L}$=0.04mol/L;v(H2)=$\frac{△c({H}_{2})}{△t}$=$\frac{0.04mol/L}{10min}$=0.004mol/(L•min),
故答案为:0.04mol/L;0.004mol/(L•min);
(5)接触面积越大,化学反应速率越快,故铝粉代替铝片实验效率更高,原因是铝粉与盐酸接触面积更大,反应速率加快,
故答案为:铝粉与盐酸接触面积更大,反应速率加快;
(6)化学反应前后元素守恒,故可能含有杂质的化学式为HCl,H2O,
故答案为:HCl,H2O.
点评 本题是一道实验探究题,考查了温度,接触面积对化学反应速率的影响,以及浓度,反应速率的计算,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | R可能为乙二酸 | |
| B. | N可能为对苯二甲酸 | |
| C. | 高聚物M为加聚产物 | |
| D. | 含有羧基的物质在常温下均易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Na2He中各微粒的最外层电子均达到稳定结构 | |
| B. | 合成Na2He不可能在常温常压下进行 | |
| C. | 定量研究的方法能够促进化学科学的发展 | |
| D. | He与H具有相同的电子层结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同分异构体之间分子式相同,其相对分子质量也一定相等,则相对分子质量相等的物质一定是同分异构体 | |
| B. | 同分异构体之间某种元素的质量分数均相同,化合物之间某种元素质量分数均相同的物质一定为同分异构体 | |
| C. | 两种物质如果互为同分异构体,则一定不可能为同系物 | |
| D. | 两种物质如果互为同分异构体,则它们的命名可能一样 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中加入适量的 AgNO3溶液,有白色沉淀产生,则原溶液中一定有 Cl- | |
| B. | 向某溶液中加入稀盐酸无明显现象,再加 AgNO3溶液有白色沉淀产生,则原溶液中一定有Cl- | |
| C. | 向某溶液中加入 BaCl2溶液有白色沉淀产生,再加盐酸,沉淀不溶解,则原溶液中一定有SO42- | |
| D. | 向某溶液中加入稀盐酸,无明显现象,再加 BaCl2溶液有白色沉淀产生,则原溶液中一定有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中的氧化剂只有Cu2O | |
| B. | Cu2S在反应中既是氧化剂又是还原剂 | |
| C. | Cu既是氧化产物又是还原产物 | |
| D. | 生成1 mol Cu,转移2 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氨水中加入碳酸钙固体,溶液pH增大 | |
| B. | 锌的金属活动性比铁强,可在海轮外壳上装上锌块以减缓船体腐蚀 | |
| C. | 需加热才能发生的反应一定是吸热反应 | |
| D. | 2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下可自发进行,则该反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制备Fe(OH)3胶体:向饱和氯化铁溶液中滴加氨水 | |
| B. | 除去FeCl2溶液中的少量FeCl3:加入足量铁屑,充分反应后,过滤 | |
| C. | 检验食盐中是否含有KIO3:取少量食盐溶液,加稀硫酸酸化,再滴入淀粉溶液,观察实验现象 | |
| D. | 证明在相同温度下Ksp[Mg(OH)2]>Ksp[Fe(OH)3]:向10mL0.2 mol•L-1NaOH溶液中滴入2滴0.1 mol•L-1MgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol•L-1 FeCl3溶液,观察现象 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com