
【题目】在甲烧杯中放入盐酸,乙烧杯中放入醋酸,两种溶液的体积和c(H+)都相等,向两烧杯中同时加入两颗锌粒,反应结束后得到等量的氢气,有一个烧杯中有锌粒剩余。下列说法正确的是
A. 两烧杯中参加反应的锌等量
B. 盐酸物质的量浓度比醋酸大
C. 乙烧杯中的锌粒剩余
D. 甲烧杯的反应时间更短
【答案】A
【解析】
A.由题意知反应结束后得到等量的氢气,根据反应方程式2HCl+Zn=ZnCl2+H2↑,2CH3COOH+Zn=(CH3COO)2Zn+ H2↑中计量关系可知,两烧杯中参加反应的锌等量,A正确;
B.因为盐酸和醋酸溶液中c(H+)相同,盐酸完全电离而醋酸部分电离,所以两种酸的物质的量浓度大小关系:c(HCl)<c(CH3COOH),B项错误;
C.据B项分析知两种酸的物质的量浓度大小关系:c(HCl)<c(CH3COOH),等体积两种溶液中酸的物质的量大小关系:n(HCl)<n(CH3COOH),根据2HCl+Zn=ZnCl2+H2↑,2CH3COOH+Zn=(CH3COO)2Zn+ H2↑中化学计量关系可推知,有锌粒剩余的一定是盐酸,即甲烧杯中的锌粒剩余,C项错误;
D.在反应过程中醋酸的电离平衡CH3COOH![]() CH3COO-+H+向右移动,且醋酸的浓度大于盐酸浓度,故反应过程中两种酸溶液中c(H+)大小关系:醋酸>盐酸,所以两种酸与锌反应速率大小关系:醋酸>盐酸,即乙烧杯的反应时间更短,D项错误;答案选A。
CH3COO-+H+向右移动,且醋酸的浓度大于盐酸浓度,故反应过程中两种酸溶液中c(H+)大小关系:醋酸>盐酸,所以两种酸与锌反应速率大小关系:醋酸>盐酸,即乙烧杯的反应时间更短,D项错误;答案选A。


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应,转化关系中有些反应的产物和反应的条件没有全部标出。
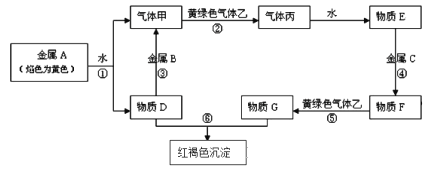
请根据以上信息回答下列问题:
(1)写出金属元素A在周期表中的位置:____________,物质D的电子式:____________。
(2)写出下列反应的离子方程式:反应③__________________________________;
反应⑤_______________________________________。
(3)检验物质G中阳离子的操作方法 ________________________________________。
(4)实验室制取黄绿色气体乙的化学方程式为 _________________________________,在该反应中如有0.5mol乙生成,转移电子的物质的量是______mol,制取完毕,多余的乙将用D的水溶液来吸收,其离子方程式为 ______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应速率的说法中,正确的是( )
A. 反应C(s)+H2O(g)![]() CO(g)+H2(g),增加碳的用量可加快反应速率
CO(g)+H2(g),增加碳的用量可加快反应速率
B. 用铁片与稀硫酸反应制H2,改用98%的浓硫酸可加快生成H2的速率
C. 用锌片与稀盐酸反应,加入适量的NaCl溶液,反应速率不变
D. 反应2SO2(s)+O2(g)![]() 2SO3(g)在密闭容器中进行,压缩容器体积,反应速率增大
2SO3(g)在密闭容器中进行,压缩容器体积,反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列物质:①Cl2 ②Na2O2 ③NaOH ④HCl ⑤H2O2 ⑥MgF2 ⑦NH4Cl
(1)只由非极性键构成的物质是___(填编号,下同);
(2)由离子键和极性键构成的物质是___;
(3)属于共价化合物的物质是___;
(4)⑤H2O2的电子式为:___;
(5)用电子式表示⑥MgF2的形成过程:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮及其化合物对化工生产有重要意义。
(1)已知:N2(g)+O2(g)=2NO(g); △H=+180 kJ·mol-1
4NH3(g)+5O2(g) =4NO(g)+6H2O(g); △H= -908 kJ·mol-1
请写出氨气被一氧化氮氧化生成无毒气体的热化学方程式:___________。
(2)工业合成氨的原理为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1。下图甲表示在一定体积的密闭容器中反应时N2的物质的量浓度随时间的变化,图乙表示在其他条件不变的情况下,改变起始投料中H2与N2的物质的量之比(设为k)对该平衡的影响。
2NH3(g) ΔH=-92.4 kJ·mol-1。下图甲表示在一定体积的密闭容器中反应时N2的物质的量浓度随时间的变化,图乙表示在其他条件不变的情况下,改变起始投料中H2与N2的物质的量之比(设为k)对该平衡的影响。

①已知图甲中0~t1 min内,v(H2)=0.03 mol·L-1·min-1,则t1=________ min;若从t2 min起仅改变一个反应条件,则所改变的条件可能是____________________________(填一种即可)。
②图乙中,b点时k=_________。
③已知某温度下该反应的平衡常数K=10,在该温度下向容器中同时加入下列浓度的混合气体:c(H2)=0.1 mol/L,c(N2)=0.5 mol/L,c(NH3)=0.1 mol/L,则在平衡建立过程中NH3的浓度变化趋势是__________(填“逐渐增大”“逐渐减小”或“恒定不变”)。
(3)联氨(又称肼,N2H4,无色液体)为二元弱碱,在水中的电离方式与氨相似,是一种应用广泛的化工原料,可用作火箭燃料。(已知:N2H4+H+![]() N2H5+)
N2H5+)
①N2H5+的电子式为_______。联氨与硫酸形成的酸式盐的化学式为________。
②联氨是一种常用的还原剂。向装有少量AgCl的试管中加入联氨溶液,观察到的现象___________________________________________________________。
(4)尿素(CO(NH2)2)是目前使用量较大的一种化学氮肥,工业上利用下图所示装置(阴、阳极均为惰性电极)电解尿素的碱性溶液制取氢气。
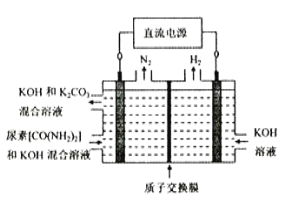
①该装置中阳极的总电极反应式为_____________________________________________。
②若两极共收集到气体22.4L(标准状况),则消耗的尿素为____________g(忽略气体的溶解)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①~⑩十种元素在周期表中的位置。
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ④ | ⑩ | |||||
3 | ⑤ | ⑥ | ⑦ | ③ | ⑧ | ⑨ | ||
回答下列问题:
(1)①、④按原子个数比1:1 组成的分子的电子式为____________________ ;由②、④两种元素组成的一种无毒化合物的结构式为 _____________________。
(2)这10种元素中,化学性质最不活泼的元素是_____________(填元素符号,下同),得电子能力最强的原子是__________________,失电子能力最强的单质与水反应的化学方程式是_________________________。
(3)用化学方程式表示②和⑨两种元素的非金属性强弱:________________________ 。
(4)元素③的气态氢化物和元素⑧的气态氢化物中,易于制备的是 ____________________(填化学式)
(5)元素⑤的最高价氧化物对应的水化物与元素⑦的最高价氧化物对应的水化物反应,其离子方程式为 ______________________________。
(6)元素 ①、④、⑤两两之间可以形成两种类型的化合物,写出一种共价化合物的化学式:___________________ ;写出一种离子化合物的化学式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用CO2和H2反应合成甲醇。
已知25°C、101 kPa下:
H2(g)+1/2O2(g)=H2O (g) △H1= - 242kJ/mol
CH3OH(g)+3/2O2(g) =CO2(g)+2H2O(g) △H2= - 676kJ/mol
(1)写出CO2与H2反应生成CH3OH(g)与H2O (g)的热化学方程式_________________。常温下,某实验中将6 mol CO2和8 mol H2充入2 L的密闭容器中,测得H2的物质的量随时间变化如图曲线 (甲)所示。请完成下列问题:
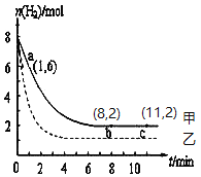
(2)该反应能在________(填“高温”或“低温”)条件下自发进行;从a点到b点,用H2表示该反应的平均化学反应速率是____________。(保留两位有效数字),a点逆反应速率_____b点逆反应速率(填“>”、“<”或“=”);达平衡时,CO2的转化率是_____。
(3)若仅改变某一实验条件再进行一次实验,测得H2的物质的量随时间变化如图中虚线(乙)所示,曲线(乙)对应改变的实验条件可以是________(填序号)。
a.加催化剂 b.增大压强 c.升高温度 d.增大H2浓度
(4)若曲线甲b点达到平衡时体系压强为100MPa,此时H2的平衡分压为_______MPa。(某物质分压=总压×某物质的物质的量分数)
(5)下列叙述能标志该反应达到化学平衡状态的是_________
a.CO2与H2的转化率之比不变 b.υ(生成H2) : υ(消耗H2O) = 3:1
c.混合气体的相对分子质量不变 d.甲醇与水蒸气的分压比不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨和硝酸都是重要的工业原料。
(1)标准状况下,将500 L氨气溶于水形成1 L氨水,则此氨水的物质的量浓度为__mol· L-1(保留三位有效数字)。工业上常用过量氨水吸收二氧化硫,该反应的化学方程式为__。
(2)氨氧化法是工业生产中合成硝酸的主要途径。合成的第一步是将氨和空气的混合气通过灼热的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮,该反应的化学方程式为__。
下列反应中的氨与氨氧化法中的氨作用相同的是__。
A.2Na+2NH3===2NaNH2+H2↑ B.2NH3+3CuO===3Cu+N2+3H2O
C.4NH3+6NO===5N2+6H2O D.HNO3+NH3===NH4NO3
工业中的尾气(假设只有NO和NO2)用烧碱进行吸收,反应的离子方程式为2NO2+2OH﹣===NO2-+NO3-+H2O和NO+NO2+2OH﹣===□ +H2O(配平该方程式)。______________
(3)向27.2 g Cu和Cu2O的混合物中加入某浓度的稀HNO3500 mL,反应过程中产生的气体只有NO。固体完全溶解后,在所得溶液(金属阳离子只有Cu2+)中加入1 L 1 mol·L-1的NaOH溶液使金属离子恰好完全沉淀,此时溶液呈中性,所得沉淀质量为39.2 g。
①Cu与稀HNO3反应的离子方程式为__。
②Cu与Cu2O 的物质的量之比为__。
③HNO3的物质的量浓度为__mol·L-1。
(4)有H2SO4和HNO3的混合溶液20 mL,加入0.25 molL﹣1Ba(OH)2溶液时,生成沉淀的质量w(g)和Ba(OH)2溶液的体积V(mL)的关系如图所示(C 点混合液呈中性)。则原混合液中H2SO4的物质的量浓度为__mol·L-1,HNO3的物质的量浓度为__mol·L-1。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子在指定溶液中能大量共存的是
A. 0.1 mol·L1NaOH溶液:Na+、K+、![]() 、
、![]()
B. 0.1 mol·L1FeCl2溶液:K+、Mg2+、![]() 、
、![]()
C. 0.1 mol·L1K2CO3溶液:Na+、Ba2+、Cl、OH
D. 0.1 mol·L1H2SO4溶液:K+、![]() 、
、![]() 、
、![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com