
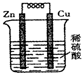
| A. | 铜片为正极,锌片为负极 | B. | 锌片溶解,质量减少 | ||
| C. | 铜片上有气泡产生 | D. | 电子由铜片经导线流向锌片 |
分析 锌、铜和稀硫酸组成的原电池中,锌作负极,负极上锌失电子发生氧化反应;铜作正极,正极上氢离子得电子发生还原反应;电子从负极沿导线流向正极;原电池中化学能转化为电能.
解答 解:A、锌、铜和稀硫酸组成的原电池中,锌比铜活泼,Zn作负极,Cu作正极,故A正确;
B、Zn、Cu、硫酸构成原电池,Zn作负极失电子发生氧化反应,则质量减少,故B正确;
C、Zn、Cu、硫酸构成原电池,铜上是电解质离子中的氢离子放电生成氢气,所以铜片上有气泡产生,故C正确;
D、锌、铜和稀硫酸组成的原电池中,锌作负极,铜作正极,电子从负极沿导线流向正极,即电子由锌片通过导线流向铜片,故D错误;
故选D.
点评 本题考查学生原电池的工作原理,注意把握正负极的判断、电极方程式的书写、电子流向等,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径:O>N>C | B. | 碱性:LiOH>NaOH>KOH | ||
| C. | 非金属性:P>S>Cl | D. | 气态氢化物稳定性:HF>HCl>H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡是中心原子采取sp3杂化轨道成键的分子其几何构型都是正四面体 | |
| B. | CH4分子中的sp3杂化轨道是由4个H原子的1s 轨道和C原子的2p轨道混合起来而形成的 | |
| C. | 乙炔分子中,两个碳原子均采用sp2杂化轨道成键 | |
| D. | sp3杂化轨道是由同一个原子中能量相近的s 轨道和p轨道混合起来形成的一组能量相等的新轨道 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| X | X最外层电子数是次外层电子数的2倍 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的非金属性大于Y |
| W | W的一种核素的质量数为23,中子数为12 |
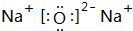 、
、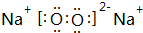 ;
;  写出X元素的最高价氧化物的电子式
写出X元素的最高价氧化物的电子式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅦA | ⅧA | O |
| 2 | N | O | F | |||||
| 3 | Na | Mg | Al | S | Cl | Ar | ||
| 4 | K | Ca |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.04 mol/(L•s) | B. | 0.08 mol/(L•s) | C. | 0.4 mol/(L•s) | D. | 0.8 mol/(L•s) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com