
【题目】乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
相对分子质量 | 密度/(gcm-3) | 沸点/℃ | 水中溶解性 | |
异戊醇 | 88 | 0.8123 | 131 | 微溶 |
乙酸 | 60 | 1.0492 | 118 | 溶 |
乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
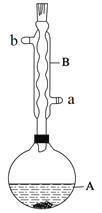
实验步骤:
在A中加入4.4 g异戊醇(3-甲基-1-丁醇)、6.0 g乙酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50 min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9 g。
回答下列问题:
(1)仪器B的具体名称是____________,实验时冷却水的进水口是_____(a或b)。
(2)在洗涤操作中,先水洗再饱和NaHCO3溶液洗而不是直接用饱和NaHCO3溶液洗涤的原因是____________________。
(3)该制备反应的化学反应方程式为__________________________。
(4)本实验中加入过量乙酸的目的是___________________________。
(5)本实验中不能用生石灰代替无水MgSO4的原因________________________。
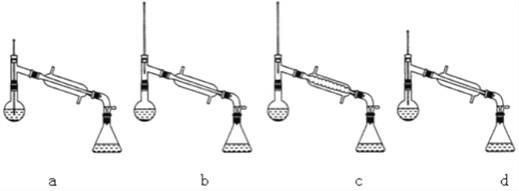
(6)在蒸馏操作中,仪器选择及安装都正确的是___________(填标号)。
(7)本实验的产率是___________________________
【答案】 球形冷凝管 a 过量的乙酸会直接消耗NaHCO3,浪费试剂 ![]() 提高醇的转化率 导致酯水解 b 60%
提高醇的转化率 导致酯水解 b 60%
【解析】本题考查物质制备,为高频考点,考查了常见仪器的构造与安装,混合物的分离和提纯,物质的制备、药品的选择及使用、物质产率的计算等知识,综合性较强且题目信息量较大,侧重考查学生实验操作、实验分析判断能力,题目难度中等。
(1)由装置中仪器B的构造可知,仪器B的名称为球形冷凝管;为了实验时冷凝管中充满水,所以进水口为a;(2)反应中剩余的乙酸可以和碳酸氢钠反应,过量的乙酸会直接消耗NaHCO3,浪费试剂,若先用水洗涤,可以减少溶液中的乙酸的存在,减少碳酸氢钠的使用量;(3) 乙酸和异戊醇逆反应生成乙酸异戊酯和水,方程式为:![]() ; (5)酯化反应为可逆反应,增加乙酸的加入量,可以提高醇的转化率。(6)酯可以在酸性或碱性条件下水解,所以不能用生石灰代替无水硫酸镁;(6) 在蒸馏实验中温度计的水银球蒸馏烧瓶的支管口处,所以ad错误,c中使用的是球形冷凝管容易使产品滞留,不能全部收集到锥形瓶中,所以仪器及装置安装正确的是b;(7)乙酸的物质的量为6.0/60=0.1mol,异戊醇的物质的量为4.4/88=0.05mol,由于乙酸和异戊醇是按照1:1进行反应,所以乙酸过量,生成乙酸异戊酯的量要按照异戊醇的物质的量计算,即理论上生成0.05mol乙酸异戊酯,实际上生成的乙酸异戊酯的物质的量为3.9/130=0.03mol,所以实验中乙酸异戊酯的产率为0.03/0.05= 60%。
; (5)酯化反应为可逆反应,增加乙酸的加入量,可以提高醇的转化率。(6)酯可以在酸性或碱性条件下水解,所以不能用生石灰代替无水硫酸镁;(6) 在蒸馏实验中温度计的水银球蒸馏烧瓶的支管口处,所以ad错误,c中使用的是球形冷凝管容易使产品滞留,不能全部收集到锥形瓶中,所以仪器及装置安装正确的是b;(7)乙酸的物质的量为6.0/60=0.1mol,异戊醇的物质的量为4.4/88=0.05mol,由于乙酸和异戊醇是按照1:1进行反应,所以乙酸过量,生成乙酸异戊酯的量要按照异戊醇的物质的量计算,即理论上生成0.05mol乙酸异戊酯,实际上生成的乙酸异戊酯的物质的量为3.9/130=0.03mol,所以实验中乙酸异戊酯的产率为0.03/0.05= 60%。


科目:高中化学 来源: 题型:
【题目】某强酸性溶液中可能存在Al3+、Fe2+、NH4+、Ba2+、Cl-、CO32-、SO42-、NO3-中的若干种,现取适量溶液进行如下实验
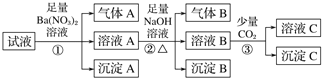
下列有关判断正确的是
A. 原溶液中一定有.Fe2+、Al3+、SO42-、NH4+、H+
B. 原溶液中一定没有Ba2+、CO32-、NO3-
C. 步骤③中反应的离子方程式为2AlO2—+CO2+3H2O=2Al(OH)3↓+CO32-
D. 气体A、B之间肯定不能发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究元素周期表中元素性质的递变规律,设计了如下实验。
Ⅰ.(1)将外观相近的钠、钾、镁、铝各1克分别投入到足量的同浓度的盐酸中,试预测实验结果:__与盐酸反应最剧烈,___与盐酸反应的速度最慢;__与盐酸反应产生的气体最多。
(2)向H2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为_______
Ⅱ.利用下图装置可验证同主族元素非金属性的变化规律
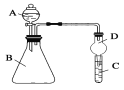
(3)仪器A的名称为________
(4)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液_____(填现象),即可证明
(5)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液观察到C中_______(填现象),即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰试验,应在两装置间添加装有_______溶液的洗气瓶除去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的叙述不正确的是
A. 氧化镁(熔点2800℃)是优质的耐高温材料
B. 还原铁粉可用作食品袋内的抗氧化剂
C. 高炉炼铁过程中用石灰石与二氧化硅反应形成炉渣
D. 晶体硅是一种半导体材料,常用于制造光导纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某探究小组用盐酸与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HCl浓度为1.00mol/L、2.50mol/L,大理石有细颗粒和粗颗粒两种规格,实验温度为25℃、40℃,每次实验盐酸的用量为25.00mL,大理石用量为10.00g。
(1)写出盐酸与大理石反应的化学方程式________
(2)请完成以下实验设计表,并把实验中空缺处补充完整:
实验 编号 | 温度 (℃) | 大理石 规格 | HCl浓度(mol/L) | 实验目的 |
① | 25 | 粗颗粒 | 2.50 | (I)实验①和②探究温度对反应速率的影响; (II)实验①和③探究浓度对反应速率的影响; (III)实验①和④探究______对反应速率的影响 |
② | __ | 粗颗粒 | 2.50 | |
③ | 25 | 粗颗粒 | ___ | |
④ | 25 | 细颗粒 | 2.50 |
(3)实验①中CO2质量随时间变化的关系见下图。计算实验①中70s-90s范围内用HCl表示的平均反应速率 ______(忽略溶液体积变化)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、在下列转化关系中,烃A为石油的裂解气里含量较高的气体(碳元素的质量分数为0.857),B分子中含有三元环,分子式为C2H4O;1molD与足量Zn反应生成22.4LH2(标准状况);E为六元环化合物。请回答下列问题:
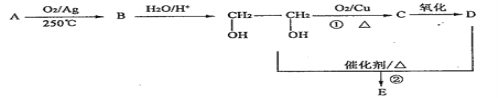
(1)A 的结构简式____________。
(2)①的反应类型为___________。
(3)D中官能团的名称是____________。
(4)写出反应②的化学方程式___________。
Ⅱ、化合物W可用作高分子膨胀剂,一种合成路线如下:
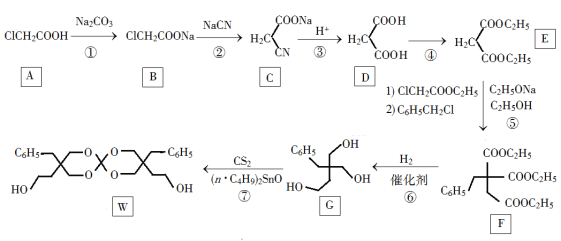
(1)A的化学名称为________。
(2)②的反应类型是__________。
(3)G的分子式为________。
(4)写出与E互为同分异构体的酯类化合物的结构简式(核磁共振氢谱为两组峰,峰面积比为1∶1)______________。(写出一种即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示元素周期表前四周期的一部分,关于元素X、Y、Z、W的叙述正确的是( )

①X、Y的最高价氧化物的水化物酸性为Y<X;②Y、Z的气态氢化物的稳定性Y<Z;③W的单质常温下呈液态,一定条件下可与铁粉反应;④W的原子序数比Z大9。
A. 只有③ B. ①② C. ①②③ D. ①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com