
分析 (1)根据配制溶液的体积选用容量瓶的规格;
弱电解质的水溶液中,弱电解质只有部分电离,反应速率与氢离子浓度成正比;
(2)只有改变条件时,才能证明改变条件弱电解质平衡发生移动;
①使HA的电离程度和c(H+)都减小,c(A-)增大,则应该加入含有A-的物质;
②使HA的电离程度减小,c(H+)和c(A-)都增大,则应加入浓的HA溶液;
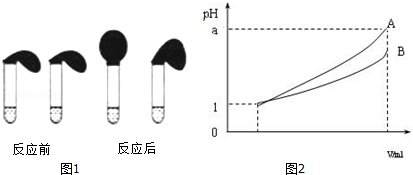
(3)稀释相同的倍数,A的变化大,则A的酸性比B的酸性强,溶液中氢离子浓度越大,酸性越强,对于一元强酸来说c(酸)=c(H+),但对于一元弱酸,c(酸)>c(H+).
解答 解:(1)配制100mL溶液,需要选用规格为100mL的容量瓶;
弱电解质的水溶液中,弱电解质只有部分电离,则0.1mol•L-1的HA溶液中氢离子浓度小于0.1mol/L,所以溶液的pH>1,反应速率与氢离子浓度成正比,等浓度的HA和盐酸溶液中,HA中氢离子浓度小,所以开始时反应速率慢,则试管上方的气球鼓起慢,
故答案为:100;>,B;
(2)只有改变条件时,才能证明改变条件弱电解质平衡发生移动,所以②能证明改变条件弱电解质平衡发生移动;
①使HA的电离程度和c(H+)都减小,c(A-)增大,则应该加入含有A-的物质,故选A;
②使HA的电离程度减小,c(H+)和c(A-)都增大,则应加入浓的HA溶液,故选D;
故答案为:②,A;D;
(3)A.两种电解质的强弱未知,无法确定两种酸浓度的大小,故A错误;
B.溶液的pH越大,氢离子浓度越小,其酸性越弱,故B正确;
C.若a=4,A完全电离,则A是强酸,B的pH变化小,则B为弱酸,故C正确;
D.pH=1的酸,加水稀释到1000倍,若pH=4,为强酸,若a<4,则A、B 都是弱酸,故D正确;
故答案为:A.
点评 本题考查了探究实验,题目难度中等,知道弱电解质电离特点、明确强酸与弱酸在稀释时pH变化程度大、酸的浓度和氢离子的浓度的关系是解答本题的关键,试题充分考查了学生的分析、理解能力及灵活应用基础知识的能力.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:选择题
| A. | 滴有酚酞的氨水中加入少量NH4Cl固体,溶液颜色变浅 | |
| B. | 等浓度的小苏打溶液与烧碱溶液等体积混合:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) | |
| C. | 向pH=12的NaOH溶液中滴加pH=2的HA溶液达中性:则体积V(HA)≤V(NaOH) | |
| D. | 已知298K时氢氰酸(HCN)的Ka=4.9×10-10、碳酸的Ka1=4.4×10-7,Ka2=4.7×10-11,据此可推测将氢氰酸加入到碳酸钠溶液中能观察到有气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的原子晶体和分子晶体互为同素异形体 | |
| B. | CO2的原子晶体和CO2的分子晶体具有相同的物理性质 | |
| C. | 对于CO2原子晶体,“CO2”是化学式,不是分子式 | |
| D. | CO2原子晶体在一定条件下转化为分子晶体的变化是物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 2种 | C. | 1种 | D. | 无,都有变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝在空气中耐腐蚀,所以铝是不活泼金属 | |
| B. | 铝在高温下能还原锰、铁、铬等金属氧化物得到金属 | |
| C. | 点燃的镁条插入盛有N2的集气瓶中,立即熄灭 | |
| D. | 因为镁和铝在空气中都能形成氧化膜,所以镁铝都不能溶于浓硝酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com