
| A. | CO2、CO、O2、CaO | B. | O2、CO、CO2、CaCO3 | C. | O2、CO2、CO、CaCO3 | D. | CO、CO2、O2、Ca(OH)2 |
科目:高中化学 来源: 题型:选择题
| A. | 羊毛与涤纶-灼烧 | B. | 铝片与银片-加稀硫酸 | ||
| C. | 硬水与软水-过滤 | D. | 食盐水与食醋-闻气味 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应2Mg+CO2$\frac{\underline{\;\;△\;\;}}{\;}$2MgO+C△H<0从熵变角度看,可以自发进行 | |
| B. | 在密闭容器发生可逆反应:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-113.0kJ/mol,达到平衡后,保持温度不变,缩小容器体积,重新达到平衡后,△H变小 | |
| C. | 已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2.0×10-12,将等体积浓度为1.0×10-4mol/L的AgNO3溶液滴入到浓度均为1.0×10-4mol/L的KCl和K2CrO4的混合溶液中产生两种不同沉淀,且Ag2CrO4沉淀先产生 | |
| D. | 根据HClO的Ka=3.0×10-8,H2CO3的Ka1=4.3×10-7,Ka2=5.6×10-11,可推测相同状况下,等浓度的NaClO与Na2CO3溶液中,pH前者小于后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
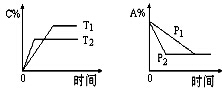 可逆反应:aA(g)+bB(s)?cC(g)+d D(g),当其他条件不变时,反应过程中某物质在混合物中的百分含量与温度(T)、压强(P)的关系如图所示,下列判断正确的是( )
可逆反应:aA(g)+bB(s)?cC(g)+d D(g),当其他条件不变时,反应过程中某物质在混合物中的百分含量与温度(T)、压强(P)的关系如图所示,下列判断正确的是( )| A. | T1<T2 △H>0 | B. | T1>T2 △H<0 | ||
| C. | P1<P2 a=c+d | D. | P1<P2 a+b=c+d |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有1.5 mol氢气 | B. | 含有9.03×1023个氢分子 | ||
| C. | 含有1.204×1024个氢原子 | D. | 气体质量为3g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag | |
| C. | 硝酸银溶液中滴入食盐水:Cl-+Ag+═AgCl↓ | |
| D. | 稀盐酸滴在石灰石上:CaCO3+2H+═Ca2++H2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知:pM=-lgc(M),pc(CO32-)=-lgc(CO32-).下列说法正确的是BD.
一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知:pM=-lgc(M),pc(CO32-)=-lgc(CO32-).下列说法正确的是BD.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
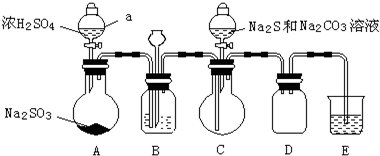
| 推测 | 操作和现象 | 结论 |
| 杂质中的正盐成分可能有: Na2S、Na2CO3 Na2SO4 及Na2SO3 | ①取Wg产品配成稀溶液; ②向溶液中滴加过量BaCl2溶液,有白色沉淀生成,过滤,得沉淀和滤液; ③向沉淀中加入过量盐酸,沉淀完全溶解,并有刺激性气味的气体产生. | 产品杂质中: 一定含有Na2SO3, 可能含有Na2CO3, 一定不含有Na2S、Na2SO4. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com