
����Ŀ�������й��ĸ����õ绯ѧװ�õ������У���ȷ����![]() ����
����![]()
|
|
|
|
ͼ�����п�̵�� | ͼ��Ǧ���� | ͼ���⾫��ͭ | ͼ������ȼ�ϵ�� |
A. ͼ����ʾ����У�MnO2���������缫��Ӧʽ��2H2O+2e-=H2��+2OH-
B. ͼ����ʾ��طŵ�����У������·ͨ��1mol����ʱ�������ϸ��������������96g
C. ͼ����ʾװ�ù��������У�����������������������������������
D. ͼ����ʾ����У�����KOH��Һ����H2SO4��Һ����Na2SO4��Һ����ص��ܷ�Ӧʽ����
���𰸡�D
��������
A.�����϶������̵õ��ӷ�����ԭ��Ӧ���缫��ӦʽΪMnO2+e-+H2O=MnO(OH)+OH-��A����
B.�����ĵ缫��ӦʽΪ��Pb(s)+SO42-(aq)+2e-=PbSO4(s)�����Ե����·ͨ��1mol����ʱ�������ϸ��������������48g��B����
C.��ͭ�ľ����У������ϲ���ͭʧ���ӻ�����������ʧ���ӣ�������ֻ��ͭ���ӵõ��ӣ���ת�Ƶ������ʱ����������������������������������������C����
D.ͼ����ʾ����У�����KOH��Һ����H2SO4��Һ����Na2SO4��Һ������ܷ�Ӧʽ��Ϊ��2H2+O2=2H2O��D��ȷ��
�ʺ���ѡ����D��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������������⡣
��1������������п�۷ֱ�Ͷ��10 mL 0.1 mol��L��1�����10 mL 0.1 mol��L��1 CH3COOH��Һ�С���п����������Ӧ�����________����д������Һ��������Һ����
��2����������п�۷ֱ�Ͷ��c��H������Ϊ1 mol��L��1�������Ϊ10 mL������ʹ�����Һ�С���п����������Ӧ�����________����д������Һ��������Һ����
��3����ˮ�ĵ���ƽ������ͼ��ʾ��

a.����A���ʾ25��ʱˮ�ڵ���ƽ��ʱ������Ũ�ȣ����¶����ߵ�100��ʱ��ˮ�ĵ���ƽ��״̬��B�㣬���ʱˮ�����ӻ����ӵ�____________��
b.��pH=8��Ba��OH��2��Һ��pH=5��ϡ�����ϣ���������100���ĺ��£���ʹ�����Һ��pH=7����Ba(OH) 2��Һ������������Ϊ___________��
��4��25��ʱ��CH3COOH��CH3COONa�Ļ����Һ������û����ҺpH��6������Һ��c��CH3COO������c��Na������________ mol/L ����ȷ��ֵ����
��5����֪NaHSO4��ˮ�еĵ��뷽��ʽΪNaHSO4=Na����H����SO42����ij�¶��£���c��H������1��10��6 mol��L��1������ˮ�м���NaHSO4���壬�����¶Ȳ��䣬�����Һ��c��H������1��10��2 mol��L��1�����жԸ���Һ��������ȷ����________________��
A�����¶ȸ���25 ��
B����ˮ���������H����Ũ��Ϊ1��10��10 mol��L��1
C��ȡ����Һ��ˮϡ��100������Һ�е�ˮ�������c��H������С
D������NaHSO4��������ˮ�ĵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����F�ĺϳ�·����ͼ��ʾ![]() ���ֲ�����ȥ
���ֲ�����ȥ![]() ��
��
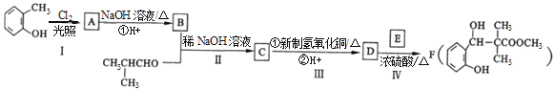
��֪����ͬһ��̼ԭ���������������ǻ�ʱ���ȶ������Զ���ˮ
��![]()
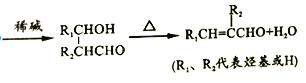
��ش��������⣺
![]()
![]() ��ϵͳ����Ϊ______��A�Ľṹ��ʽΪ___________��
��ϵͳ����Ϊ______��A�Ľṹ��ʽΪ___________��
![]() ���еĹ����������� ______________��
���еĹ����������� ______________��
![]() д������III�ڢٲ���Ӧ�Ļ�ѧ����ʽ_____________����Ӧ���ķ�Ӧ����Ϊ_____��
д������III�ڢٲ���Ӧ�Ļ�ѧ����ʽ_____________����Ӧ���ķ�Ӧ����Ϊ_____��
![]() �������������£�D�������ۺϳɸ߾���仯ѧ����ʽ____________________��
�������������£�D�������ۺϳɸ߾���仯ѧ����ʽ____________________��
![]() ����G�Ļ�ѧʽΪ
����G�Ļ�ѧʽΪ![]() ��ͬʱ��������������G��ͬ���칹����_____
��ͬʱ��������������G��ͬ���칹����_____![]() д�ṹ��ʽ
д�ṹ��ʽ![]() ��
��
�ٺ˴Ź���������ʾ�����������ֲ�ͬ����
�ڳ����£�����![]() ��Һ��Ӧ��������
��Һ��Ӧ��������
�����Ȼ�����Һ����ɫ
![]() ��������ϳɷ��������Ҵ�Ϊԭ�ϣ����Լ���ѡ����ƺϳɾ�
��������ϳɷ��������Ҵ�Ϊԭ�ϣ����Լ���ѡ����ƺϳɾ�![]() ��ϩȩ
��ϩȩ![]() ����·ͼ��__________________________________________________���ϳ�·��ʾ�����£�CH2=CH2
����·ͼ��__________________________________________________���ϳ�·��ʾ�����£�CH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������·�����Ӧ��4NO2(g)��O2(g)![]() 2N2O5(g) ��H<0��T1ʱ�������Ϊ2L�ĺ����ܱ�������ͨ��NO2��O2������ʵ�����������ʾ��
2N2O5(g) ��H<0��T1ʱ�������Ϊ2L�ĺ����ܱ�������ͨ��NO2��O2������ʵ�����������ʾ��
ʱ��/s | 0 | 5 | 10 | 15 |
c(NO2)/(mol��L��1) | 4.00 | 2.52 | 2.00 | c3 |
c(O2)/(mol��L��1) | 1.00 | c1 | c2 | 0.50 |
��1��0��10s��N2O5��ƽ����Ӧ����Ϊ__ �����¶��µ�ƽ�ⳣ��Ϊ___��
��2�������������䣬���������ѹ��һ�룬�����´ﵽƽ��ʱc(N2O5)___2.00mol��L��1������>��<��=������ͬ��
��3�������¶�T1ʱƽ�ⳣ��ΪK1���¶�T2ʱƽ�ⳣ��ΪK2����K1<K2����T1____T2��
��4�����п�����Ϊƽ������ݵ���___
A.�����ڻ���������ɫ���ٸı�
B.����1molO2��ͬʱ����2molN2O5
C.��������ƽ��Ħ���������ٱ仯
D.���������ܶȲ��ٱ仯
��5���ı���Щ��ʩ��������NO2��ƽ��ת����___������������������ϣ�
��6����֪��N2(g)+O2(g)=2NO(g) ��H=+180.5 kJ��mol1
2C(s)+O2(g)=2CO(g) ��H=��221.0 kJ��mol1
C(s)+O2(g)=CO2(g) ��H=��393.5 kJ��mol1
������β�������ķ�Ӧ֮һ��2NO(g)+2CO(g)=N2(g)+2CO2(g) ��H=___ kJ��mol1�����ڸ÷�Ӧ�Է����е�������___��ѡ������������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ƶ���ȷ����(����)
A.BF3���������
B.NH4+�ĵ���ʽ��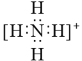 �����ӳ�ƽ���νṹ
�����ӳ�ƽ���νṹ
C.CH4�����е�4��C��H��������ԭ�ӵ�1s�����̼ԭ�ӵ�p����γɵ�sp ����
D.CH4�����е�̼ԭ����4��sp3�ӻ�����ֱ���4����ԭ�ӵ�1s����ص����γ�4��C��H ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2��I2��һ���������ܷ�����Ӧ��H2(g)+I2(g)![]() 2HI(g) ��H=��a kJ��mol-1��֪������˵����ȷ���ǣ� ��
2HI(g) ��H=��a kJ��mol-1��֪������˵����ȷ���ǣ� ��

A.H2��I2��HI�����еĻ�ѧ�����ǷǼ��Թ��ۼ�
B.��ͬ�����£�1 mol H2(g)��1 mol I2(g)��������С��2 mol HI(g)��������
C.�Ͽ�2 mol HI�����еĻ�ѧ����������ԼΪ(c+b+a)kJ
D.���ܱ������м���2 mol H2(g)��2 mol I2(g)����ַ�Ӧ��ų�������Ϊ2a kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ʵ��Ҫ�õ�����һ��������������Щ������������ա�

��1��������Cl2��ʹ������______��
��2�������뻥�����ܵ�����Һ�壬��ʹ��______��
��3��������Һ̬������зе㲻ͬ����֣���ʹ��______��
��4��������������Һ���еĹ������ʣ���ʹ��______��
��5�����õ������壨CuSO4��5H2O������ˮ����ͭ���壬��ʹ��______��
��6������ʳ��ˮ�л��ʳ�ξ��壬��ʹ��______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ����ı�ʾȷ����
A. ԭ�ӽṹʾ��ͼ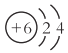 ֻ�ܱ�ʾ12Cԭ��
ֻ�ܱ�ʾ12Cԭ��
B. �Ƽ�����[KFe3(SO4)2(OH)6]�У�Fe�Ļ��ϼ�Ϊ+2
C. ![]() ϵͳ������Ϊ3-��ϩ
ϵͳ������Ϊ3-��ϩ
D. ���ĵ���ʽΪ:![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��д�����и�������ˮ�еĵ��뷽��ʽ��
��1��NH3H2O_______________________
��2��H2CO3_________________________
��3��Al(OH)3______________________
��4��NaHCO3_________________________________
��5��CH3COOH___________________________
��6��Fe2(SO4)3_______________________________
��7��NaHSO4_________________________________
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com