
【题目】某课外活动小组利用下列装置迅速制备少量氯气。提供的试剂有:浓盐酸、饱和食盐水、氢氧化钠溶液、高锰酸钾固体。(2KMnO4+16HCl(浓)→2KCl+2MnCl2+5Cl2↑+8H2O)

试回答:
(1)装置H中盛放的试剂是_________________________________________。
(2)尾气处理时关闭弹簧夹a和弹簧夹________________,打开弹簧夹________________。
(3)处理尾气时,发生反应的化学方程式是____________________________。
(4)从装置G中出来的Cl2中含有________________气体,可用________________试剂除去。
(5)标出该反应的电子转移方向和数目:2KMnO4+16HCl(浓)→2KCl+2MnCl2+5Cl2↑+8H2O_______,此反应中的氧化剂是________,被氧化的元素是________,若参加反应的氧化剂的物质的量是1mol,则产生的氯气在标准状况下的体积为________,被氧化的物质的物质的量为________(有单位的需注明单位)
【答案】饱和食盐水 b c 2NaOH+Cl2═NaCl+NaClO+H2O 氯化氢(HCl) 饱和食盐水  KMnO4 Cl 56L 5mol
KMnO4 Cl 56L 5mol
【解析】
(1)装置H是用来收集氯气的装置,氯气易溶于水,在饱和氯化钠溶液中溶解度较小,所以可以用排饱和食盐水的方法收集氯气,
故答案为:饱和食盐水;
(2)由题意可知用仪器P吸收过量的氯气,要想使反应剩余气体进入p,应关闭弹簧夹a和弹簧夹b,打开弹簧夹c;
故答案为:b;c;
(3)氯气与氢氧化钠溶液反应的化学方程式为:2NaOH+Cl2═NaCl+NaClO+H2O;
故答案为:2NaOH+Cl2═NaCl+NaClO+H2O;
(4)用反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O制取氯气,浓盐酸具有挥发性,会有氯化氢气体产生,可用饱和食盐水除去氯化氢气体。
答案为:氯化氢(HCl);饱和食盐水;
(5) ,反应中的氧化剂是KMnO4,被氧化的元素是Cl;若参加反应的氧化剂的物质的量是1mol,则生成氯气的物质的量为2.5mol,有5mol氯化氢被氧化为氯气,标况下氯气的体积为:V = 2.5mol×22.4L/mol= 56L;
,反应中的氧化剂是KMnO4,被氧化的元素是Cl;若参加反应的氧化剂的物质的量是1mol,则生成氯气的物质的量为2.5mol,有5mol氯化氢被氧化为氯气,标况下氯气的体积为:V = 2.5mol×22.4L/mol= 56L;
答案为: ;KMnO4;Cl;56L;5mol。
;KMnO4;Cl;56L;5mol。


科目:高中化学 来源: 题型:
【题目】用电化学制备正十二烷的方法:向烧杯中加入50 mL 甲醇,不断搅拌加入少量金属钠,再加入11 mL正庚酸搅拌均匀,装好铂电极,接通电源反应,当电流明显减小时切断电源,然后提纯正十二烷。已知电解总反应: 2C6H13COONa+2CH3OH![]() C12H26+2CO2↑+H2↑+2CH3ONa,下列说法不正确的是
C12H26+2CO2↑+H2↑+2CH3ONa,下列说法不正确的是
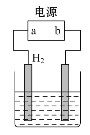
A. 图中电源的a极为直流电源的负极
B. 电解过程中离子浓度会不断降低
C. 阳极电极反应:2C6H13COO--2e-=C12H26+2CO2↑
D. 反应一段时间后将电源正负极反接,会产生杂质影响正十二烷的制备
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在标准状况下,CO和CO2的混合气体共28L,质量为51g。其中CO2的质量为_____g,混合气体中CO的物质的量分数为____。混合气体的平均摩尔质量为_______。
(2)同温同压下,同质量的NH3和H2S气体体积比为______,原子个数之比为______,密度之比为________。
(3)在120℃时分别进行如下四个反应(除S外其它物质均为气体):
A.2H2S+O2=2H2O+2S↓ B.2H2S+3O2=2H2O+2SO2
C.C2H4+3O2=2H2O+2CO2 D.C4H8+6O2=4H2O+4CO2
若反应在压强恒定、容积可变的容器内进行,反应前后气体密度(d)和气体体积(V)分别符合关系式d前>d后和V前<V后的是___________;符合d前>d后和V前>V后的是___________(填写反应的代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+10CO2↑+8H2O反应速率的影响因素,有关实验数据如下表所示:下列说法不正确的是( )
实验编号 | 温度 | 催化剂用量(g) | 酸性KMnO4溶液 | H2C2O4溶液 | KMnO4溶液褪色平均时间 min | ||
体积(mL) | 浓度mol·L-1 | 体积(mL) | 浓度 mol·L-1 | ||||
1 | 25 | 0.5 | 4 | 0.1 | 8 | 0.2 | 12.7 |
2 | 80 | 0.5 | 4 | 0.1 | 8 | 0.2 | a |
3 | 25 | 0.5 | 4 | 0.01 | 8 | 0.2 | 6.7 |
4 | 25 | 0 | 4 | 0.01 | 8 | 0.2 | b |
A. a<12.7,b>6.7
B. 用KMnO4表示该反应速率,v(实验3)<v(实验1)
C. 用H2C2O4表示该反应速率,v(实验1)约为7.87×10-5 mol·L-1·min-1
D. 可通过比较收集相同体积CO2所消耗的时间来判断反应速率快慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是 ( )
A. 1 mol CO2 的质量为44 g/mol
B. 硝酸的摩尔质量63g
C. 2gH2所含原子数目为2mol
D. 0.5molNa2SO4溶于水中,所得溶液中Na+个数为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用重铬酸钠(Na2Cr2O7)结晶后的母液(含少量杂质Fe3+)生产重铬酸钾 (K2Cr2O7),其工艺流程及相关物质溶解度曲线如下图所示。
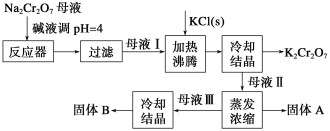
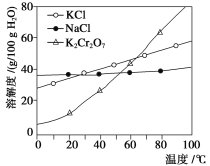
(1)向Na2Cr2O7母液中加碱液调pH的目的是_____________________。
(2)通过冷却结晶析出大量K2Cr2O7的原因是________________________________。
(3)固体A的主要成分为__________(填化学式),用热水洗涤固体A,回收的洗涤液转移到母液___________(填“I”“Ⅱ”或“Ⅲ”)中,既能提高产率又可使能耗降低。
(4)测定产品中K2Cr2O7含量的方法如下:称取产品试样2.500 g 配成250 mL溶液,用移液管取出25.00 mL于碘量瓶中,加入10 mL 2 mol·L-l H2SO4溶液和足量KI溶液(铬的还原产物为Cr3+),放置于暗处5 min,然后加入100 mL蒸馏水、3 mL 淀粉指示剂,用0.1200 mol·L-l Na2S2O3标准溶液滴定(已知I2+ 2S2O32-=2I-+S4O62-)。
①酸性溶液中KI 与K2Cr2O7反应的离子方程式为_____________________________。
②若实验中共用去Na2S2O3标准溶液40.00 mL,则所得产品中重铬酸钾的纯度为__________%( 保留2 位小数,设整个过程中其他杂质不参与反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中山大学颜光美课题组发现的一种“M1”天然病毒(直径约为70nm,外壳是蛋白质)能杀伤某些癌细胞,而不伤害正常细胞。下列有关说法中,正确的是( )
A.M1中只含C、H元素
B.蛋白质属于高分子化合物
C.M1分散在水中形成的是浊液
D.蛋白质水解的最终产物是CO2和H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 1mol萘(![]() )含有5mol碳碳双键
)含有5mol碳碳双键
B. CH3CH=CHCH2OH属于不饱和烃
C. 可用溴水鉴别苯、四氯化碳、酒精
D. 尿素[CO(NH2)2]的含氮质量分数比碳酸氢铵的低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,发生反应PCl5(g)![]() PCl3(g)+Cl2(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是
PCl3(g)+Cl2(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是
t / s | 0 | 50 | 150 | 250 | 350 |
n(PCl3) / mol | 0 | 0. 16 | 0. 19 | 0. 20 | 0. 20 |
A. 反应在前50 s 的平均速率ν(Cl2)= 0. 0032 mol·L-1·s-1
B. 保持其他条件不变,升高温度,平衡时c(PCl3)= 0. 13 mol·L-1,则反应的ΔH<0
C. 相同温度下,起始时向容器中充入1. 0 mol PCl5、0. 20 mol PCl3 和0. 20 mol Cl2 ,反应达到平衡前ν(正)<ν(逆)
D. 相同温度下,起始时向容器中充入2. 0 mol PCl3 和2. 0 mol Cl2 ,达到平衡时,PCl3 的转化率大于80%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com