
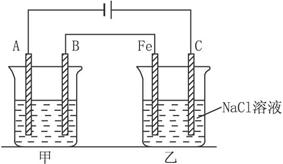
(15分)、如下图所示,甲、乙两池电极材料都是铁棒与碳棒,乙池中电子电子流动方向见图,回答下列问题:

(1)若两池中均盛200mL饱和NaCl溶液和酚酞的混合液,反应开始后:
①甲池中 极,乙池中的
极附近溶液变红(填“正”或“负”或“阴”或“阳”)。
②甲池碳极上电极反应式是
乙池中Fe电极上反应式为 。
③若乙池中收集到1.12L(标况下)有色气体时,停止实验,忽略池中溶液体积的变化,则池中溶液的c(OH—)约为 ,要使溶液恢复到电解前的相同的状况,应向溶液中补充一定量的
A.盐酸 B. NaCl固体 C. NaCl溶液 D. HCl气体
(2)若两池中均盛有200mL 2mol•L-1CuSO4溶液:
①反应一段时间后,有红色物质析出的是甲池中的 棒,乙池中的 棒。
②写出乙池通电时总反应的离子方程式: 。
③若乙池中通过1.2mol 电子后停止实验,则乙池中共可收集到气体的体积为(标准状况下)
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
 Ⅰ.如下图所示,甲、乙之间的隔板K和活塞F都可左右自由移动,甲充入2molA和1molB,乙中充入2molC和1molHe,只有A为有色气体,此时K停在O处.在一定条件下发生逆反应:2A(g)+B(g)?2C(g)△H<0;反应达到平衡后,再恢复至原温度.回答下列问题:
Ⅰ.如下图所示,甲、乙之间的隔板K和活塞F都可左右自由移动,甲充入2molA和1molB,乙中充入2molC和1molHe,只有A为有色气体,此时K停在O处.在一定条件下发生逆反应:2A(g)+B(g)?2C(g)△H<0;反应达到平衡后,再恢复至原温度.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

①甲、乙、丙、丁均为短周期元素形成的单质,常温下甲、乙、丙为气体,丁为中学化学中常见的金属单质。
②甲中所含元素的核电荷数是乙、丙所含元素的核电荷数之和。
③丁中所含元素原子的最外层电子数是乙中所含元素原子的最外层电子数的2倍。
④常温下,X是无色液体,Z是刺激性气体,X与W的反应能生成Z及另一种白色沉淀。
试回答:
(1)Y的化学式是______________,丙的电子式为______________。
(2)X与W反应的化学方程式是_______________________________________________。
(3)常温下某Z的水溶液的pH等于11,则该溶液中由水电离产生的OH-的物质的量浓度为______________。
(4)已知
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)甲池若为用电解原理精炼铜的装置,则A电极名称为________极,电极材料是________,电极反应式为________,电解质溶液可以是________。
(2)乙池中Fe极电极反应式为________,若在乙池中滴入少量酚酞试液,开始电解一段时间,铁极附近呈________色。
查看答案和解析>>
科目:高中化学 来源:2009—2010学年福州八中高二下学期期中考试化学卷 题型:填空题
(15分)、如下图所示,甲、乙两池电极材料都是铁棒与碳棒,乙池中电子电子流动方向见图,回答下列问题: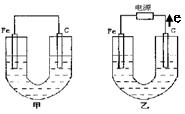
(1)若两池中均盛200mL饱和NaCl溶液和酚酞的混合液,反应开始后:
①甲池中 极,乙池中的
极附近溶液变红(填“正”或“负”或“阴”或“阳”)。
②甲池碳极上电极反应式是
乙池中Fe电极上反应式为 。
③若乙池中收集到1.12L(标况下)有色气体时,停止实验,忽略池中溶液体积的变化,则池中溶液的c(OH—)约为 ,要使溶液恢复到电解前的相同的状况,应向溶液中补充一定量的 
| A.盐酸 | B.NaCl固体 | C.NaCl溶液 | D.HCl气体 |

查看答案和解析>>
科目:高中化学 来源:2010—2011学年黑龙江省鹤岗一中高一下学期期末考试化学试卷 题型:填空题
(9分)如下图所示,甲、乙为相互串联的两电解池。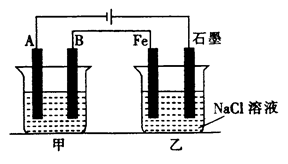
试回答:
(1)乙池中Fe电极为 极。若在乙池中滴入少量酚酞试液,开始电解一段时间后,铁电极附近呈 色。
(2)甲池若为精炼铜(假设粗铜的组成是均匀的,且其中活泼和不活泼的成份均存在)的装置,则电解质溶液可以是 ;通过一段时间后,A电极增重12.8g,则甲池溶液原溶质的浓度 (填“增大”、“减小”、“不变”或“无法确定”),乙池石墨电极放出的气体在标准状况下的体积为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com