
| A、向AgCl饱和溶液中加入NaCl固体,AgCl的Ksp增大 |
| B、AgCl不溶于水,溶液中没有Cl-和Ag+ |
| C、AgCl沉淀的生成和溶解仍在不断进行,但速率相等 |
| D、向AgCl饱和溶液中加入NaCl固体,没有AgCl产生 |


 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:
| A、6.72L |
| B、3.36L |
| C、8.96L |
| D、4.48L |
查看答案和解析>>
科目:高中化学 来源: 题型:
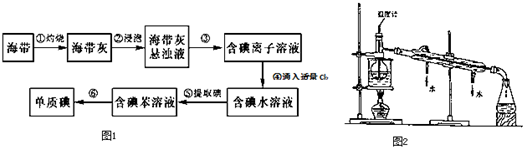
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用玻璃棒蘸取氯水溶液,滴在pH试纸上,待变色后与比色卡对照,确定氯水的pH |
| B、因为Ksp(CaCO3)<Ksp(CaSO4),所以可用Na2CO3和HCl除去水垢中的CaSO4 |
| C、均不能采取将溶液直接蒸干的方法制得AlCl3、Al2(SO4)3、FeCl3、Fe2(SO4)3 |
| D、滴定用的滴定管、锥形瓶和配制一定物质的量浓度溶液用的容量瓶,使用前均要润洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |

查看答案和解析>>
科目:高中化学 来源: 题型:
 现有三个反应:
现有三个反应:| T/℃ | 700 | 800 |
| K1 | 2.38 | 2.56 |
| K2 | 0.80 |
| 反应时间/min | 0 | 2 | 4 | 6 |
| n(CO)/mol | 1.20 | 0.90 | 0.80 | |
| n(H2O)/mol | 0.60 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 浓硫酸 |
| 170℃ |
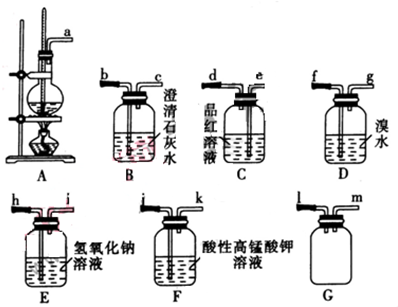
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、增加溶液pH |
| B、加入2.0mol?L-1 NH4Cl |
| C、加入0.1mol?L-1 MgSO4 |
| D、加入适量95%乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 离子或分子 | 要求 |
| A | K+、NO3-、Cl-、HS- | c(K+)<c(Cl-) |
| B | Fe3+、NO3-、SO32-、Cl- | 滴加盐酸立即有气体产生 |
| C | NH4+、Al3+、SO42-、CH3COOH | 滴加NaOH溶液立即有气体产生 |
| D | Na+、HCO3-、Mg2+、SO42- | 滴加氨水立即有沉淀产生 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com