
【题目】某反应过程能量变化如图所示,下列说法正确的是
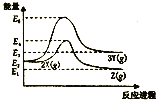
A. 由X→Y反应的ΔH=E2-E3
B. 降低压强有利于提高X→Z的转化率
C. 升高温度有利于提高X→Z的反应速率
D. 由图可知,等物质的量的Y的能量一定比X的能量高
 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
【题目】CO2的有效利用可以缓解温室效应和能源短缺问题。
(1)CO2的分子结构决定了其性质和用途。
①CO2的电子式是_____________。
②在温度高于31.26 ℃、压强高于7.29×106Pa时,CO2处于超临界状态,称为超临界CO2流体,它可用作萃取剂提取草药中的有效成分。与用有机溶剂萃取相比,用超临界CO2萃取的优点有:___________(答出一点即可)。
(2)中科院大连化学物理研究所的科研人员在新型纳米催化剂Na-Fe3O4和HMCM-22 的表面将CO2转化为烷烃,其过程如下图。

上图中CO2转化为CO的反应为:CO2(g)+H2(g) = CO(g)+H2O(g) △H= +41kJ/mol
已知:2CO2(g)+6H2(g) = C2H4(g)+4H2O(g) △H= -128kJ/mol
①则图中CO转化为C2H4的热化学方程式是____________________。
②关于X与Y的说法正确的是________(填序号〕。
a.实验式相同 b.都有4种一氯代物
c.都易使酸性KMnO4溶液褪色 d.互为同系物
③催化剂中Fe3O4的制备方法如下:将一定比例的FeCl2和FeCl3溶于盐酸,然后在 60 ℃下逐滴加入NaOH溶液至pH≈10,继续搅拌,得Fe3O4。该反应的离子方程式是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某磁黄铁矿的主要成分是FexS(S为-2价),既含有Fe2+又含有Fe3+。将一定量的该磁黄铁矿与100 mL的盐酸恰好完全反应(注:矿石中其他成分不与盐酸反应),生成2.4 g硫单质、0.425 mol FeCl2和一定量H2S气体,且溶液中无Fe3+。则下列说法正确的是 ( )
A. 100 mL的盐酸中HCl的物质的量浓度为7.5 mol·L-1
B. 生成的H2S气体在标准状况下的体积为2.24 L
C. 该磁黄铁矿FexS中,x=0.85
D. 该磁黄铁矿FexS中,Fe2+与Fe3+的物质的量之比为3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】看下列仪器装置图,回答下列问题:
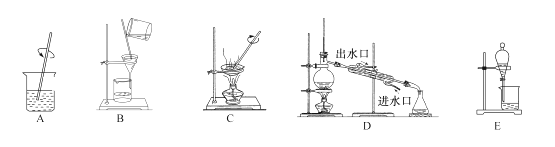
(1)粗盐的提纯需要上面的哪些装置?___________(填字母符号)
(2)分离以下混合物应该选择使用什么装置?(填字母符号)
①酒精和水:___________,
②食盐和水:___________,
③二氧化锰和KCl:___________,
④花生油和水:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将质量为W1g的钠、铝混合物投入一定量的水中充分反应,金属没有剩余,溶液澄清,共收集到标准状况下的气体V1L。向溶液中逐滴加入浓度为amol/L的盐酸,过程中有白色沉淀生成后又逐渐溶解,当沉淀恰好消失时所加盐酸体积为V2L,将溶液在HCl气氛中小心蒸干得固体W2g。下列所列关系式中正确的是
A. 35.5a=(W2-W1)V2B. n(Al)>![]() mol
mol
C. n(Na)+3n(Al)=![]() molD. aV2=
molD. aV2=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PCl3是磷的常见氯化物,可用于半导体生产的外延、扩散工序。有关物质的部分性质如下:
熔点/℃ | 沸点/℃ | 密度/ g·mL-1 | 其他 | |
黄磷 | 44.1 | 280.5 | 1.82 | 2P+3Cl2(少量) |
PCl3 | -112 | 75.5 | 1.574 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
(一)制备
如图是实验室制备PCl3的装置(部分仪器已省略)。

(1)仪器乙的名称是________;其中,与自来水进水管连接的接口编号是________。(填“a”或“b”)
(2)实验室制备Cl2的离子方程式___________________________。实验过程中,为减少PCl5的生成,应控制____________。
(3)碱石灰的作用:一是防止空气中的水蒸气进入而使PCl3水解,影响产品的纯度;二是_________。
(4)向仪器甲中通入干燥Cl2之前,应先通入一段时间CO2排尽装置中的空气,其目的是________。
(二)分析
测定产品中PCl3纯度的方法如下:迅速称取4.100 g产品,水解完全后配成500 mL溶液,取出25.00 mL加入过量的0.100 0 mol·L-1 20.00 mL碘溶液,充分反应后再用0.100 0 mol·L-1 Na2S2O3溶液滴定过量的碘,终点时消耗12.00 mL Na2S2O3溶液。
已知:H3PO3+H2O+I2===H3PO4+2HI;I2+2Na2S2O3===2NaI+Na2S4O6;假设测定过程中没有其他反应。
(5)根据上述数据,该产品中PCl3(相对分子质量为137.5)的质量分数为________。若滴定终点时俯视读数,则PCl3的质量分数________(填“偏大”“偏小”或“无影响”)。
(三)探究
(6)设计实验证明PCl3具有还原性:_____________________________________。(限选试剂有:蒸馏水、稀盐酸、碘水、淀粉)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要用480mL0.1molL-1的硫酸铜溶液,以下配制方法正确的是( )
A. 称取![]() 胆矾(CuSO4·5H2O),配成500mL溶液
胆矾(CuSO4·5H2O),配成500mL溶液
B. 称取![]() 胆矾(CuSO4·5H2O),加入500mL水配成溶液
胆矾(CuSO4·5H2O),加入500mL水配成溶液
C. 称取![]() 无水硫酸铜粉末,加入480mL水配成溶液
无水硫酸铜粉末,加入480mL水配成溶液
D. 称取![]() 无水硫酸铜粉末,加入500mL水配成溶液
无水硫酸铜粉末,加入500mL水配成溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某中学化学兴趣小组,将一包白色粉末(NaHCO3和Na2CO3的混合物)进行定量分析。现称取一份质量为27.4 g的样品,将此样品加热灼烧至质量不再变化,取出剩余物质,冷却后称重,质量为21.2g。
(1)写出加热时发生反应的化学方程式:___。
(2)分别求出该样品中NaHCO3和Na2CO3的物质的量。____、____(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①C(s)+O2(g)=CO2 (g) △H1 ②CO2(g)+C(s)=2CO(g) △H2
③2CO(g)+O2(g)=2CO2(g) △H3 ④4Fe(s)+3O2(g)=2Fe2O3(s) △H4
⑤3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H5
下列关于上述反应焓变的判断正确的是( )
A.△H1>0,△H3<0B.△H2>0,△H3>0
C.△H1=△H2+△H3D.△H3=△H4+△H5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com