
【题目】化学与科学、技术、社会、环境密切相关。下列说法错误的是
A. 锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用盐酸除去
B. 废旧钢材焊接前,可依次用饱和Na2CO3溶液、饱和NH4Cl溶液处理焊点处
C. 使用含有氯化钠的融雪剂会加快桥梁的腐蚀
D. 为防止海鲜腐烂,可将海鲜产品浸泡在硫酸铜溶液中
【答案】D
【解析】
A、先用Na2CO3溶液处理,发生沉淀的转化生成碳酸钙,碳酸钙溶于盐酸;
B、饱和Na2CO3溶液可以除去焊点处的油脂,饱和NH4Cl溶液可以除去焊点处金属氧化物;
C、融雪剂中含有的氯化钠加入水中,能降低水的凝固点,从而加快雪的溶解,在水溶液中能电离出钠离子和氯离子增强溶液的导电性,加快了桥梁的腐蚀;
D、可溶性铜盐中含有重金属离子铜离子,重金属离子可以使蛋白质变性。
A项、由平衡CaSO4(s)![]() Ca2+(aq)+SO42-(aq)可知,加入Na2CO3溶液后,CO32-与Ca2+结合生成CaCO3沉淀,Ca2+浓度减少,使CaSO4的沉淀溶解平衡向溶解方向移动,发生反应:CaSO4(s)+CO32-(aq)=CaCO3(s)+SO42-(aq),然后再加盐酸,盐酸和碳酸钙反应生成氯化钙、二氧化碳和水,从而除去硫酸钙,故A正确;
Ca2+(aq)+SO42-(aq)可知,加入Na2CO3溶液后,CO32-与Ca2+结合生成CaCO3沉淀,Ca2+浓度减少,使CaSO4的沉淀溶解平衡向溶解方向移动,发生反应:CaSO4(s)+CO32-(aq)=CaCO3(s)+SO42-(aq),然后再加盐酸,盐酸和碳酸钙反应生成氯化钙、二氧化碳和水,从而除去硫酸钙,故A正确;
B项、Na2CO3和NH4Cl中溶液中水解,溶液分别呈碱性和酸性,饱和Na2CO3溶液可以除去焊点处的油脂,饱和NH4Cl溶液可以除去焊点处金属氧化物,故B正确;
C项、、融雪剂中的氯化钠在水溶液中能电离出钠离子和氯离子,桥梁中的铁、碳和氯化钠溶液能形成原电池,原电池能加快化学反应速率,加快了桥梁的腐蚀,故C正确;
D项、可溶性铜盐中含有重金属离子铜离子,重金属离子可以使蛋白质变性,对人体有害,不能用于食品防腐,故D错误。
故选D。


科目:高中化学 来源: 题型:
【题目】下图中甲池是以甲醇为原料,KOH为电解质的高效燃料电池,电化学过程的如图,下列说法中不正确的是

A. 甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O
B. 若乙池中为足量AgNO3溶液,则阳极的电极反应为: 4OH--4e-= 2H2O+O2↑
C. 甲池中随着反应的不断进行,溶液的pH减小
D. 若乙池中为一定量CuSO4溶液,通电一段时间后,向溶液中加入0.1mol Cu(OH)2后恰好恢复到电解前的浓度和pH,则电解过程中转移的电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学电源在日常生活和高科技领域中都有广泛应用。下列说法正确的是
A.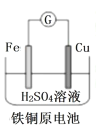 Fe 棒为负极,电极反应为 Fe-3e-= Fe3+
Fe 棒为负极,电极反应为 Fe-3e-= Fe3+
B.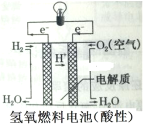 能够给用电器提供电势差,是由于两个电极上有得失电子能力不同的氢气和氧气
能够给用电器提供电势差,是由于两个电极上有得失电子能力不同的氢气和氧气
C. 锌筒作负极,发生还原反应,锌筒会变薄
锌筒作负极,发生还原反应,锌筒会变薄
D.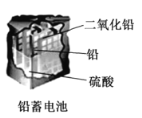 使用一段时间后硫酸铅沉淀在电极板上,溶液酸性减弱,导电能力下降
使用一段时间后硫酸铅沉淀在电极板上,溶液酸性减弱,导电能力下降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲醛(微溶于水、易溶于有机溶剂,密度约等于水的密度)在碱性条件下发生歧化反应可以制备苯甲醇(在水中溶解度不大、易溶于有机溶剂,密度约等于水的密度)和苯甲酸。反应原理如下:2C6H5CHO+NaOH→C6H5CH2OH+C6H5COONa、C6H5COONa+HCl→C6H5COOH+NaCl,有关物质物理性质如表:
苯甲醛 | 苯甲醇 | 苯甲酸 | 苯 | |
沸点/℃ | 178 | 205 | 249 | 80 |
熔点/℃ | 26 | ﹣15 | 12 | 5.5 |
苯甲酸在水中的溶解度 | ||
17℃ | 25℃ | 100℃ |
0.21 g | 0.34 g | 5.9 g |
实验流程如下:
(1)第①步需连续加热1小时(如图1),其中加热和固定装置未画出。若将仪器B改为仪器C,效果不如B,说明原因________。

(2)操作中有关分液漏斗的使用不正确的是___。
A.分液漏斗在使用之前必须检查是否漏水
B.分液漏斗内的液体不能过多,否则不利于振荡
C.充分振荡后将分液漏斗置于铁架台上静置,分层后立即打开旋塞进行分液
D.分液时等下层液体放完后立即关闭旋塞,换一个烧杯再打开旋塞使上层液体流下
(3)操作③用沸水浴加热蒸馏,再进行操作④(如图2),收集___℃的馏分。图2中有一处明显错误,正确的应改为_______。
(4)抽滤时(如图3)烧杯中苯甲酸晶体转入布氏漏斗时,杯壁上还粘有少量晶体,用___冲洗杯壁上残留的晶体,抽滤完成后洗涤晶体。
(5)用电子天平准确称取0.244 0 g苯甲酸样品于锥形瓶中,加100 mL蒸馏水溶解(必要时可以加热),再用0.100 0 molL﹣1的标准NaOH溶液滴定,共消耗NaOH溶液19.20 mL,则苯甲酸样品的纯度为___%(保留4位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填写甲烷与氯气光照时的取代反应现象
(1)试管内气体________________________
(2)试管壁出现_________________________
(3)试管中有少量_________________________
(4)水面___________,但____________(填“充满”“ 不充满”)整个试管。
(5)产物中共有_______ 种,其中____________的结构是正四面体(写名称)写出第一步取代反应:______________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SiO2是一种化工原料,可以制备一系列物质,下列说法正确的是
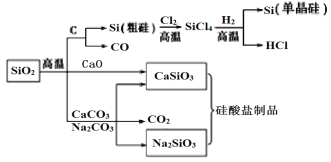
A. 图中所有反应都不属于氧化还原反应
B. 硅酸盐的化学性质稳定,常用于制造光导纤维
C. 可用盐酸除去石英砂(主要成分为SiO2)中少量的碳酸盐
D. 普通玻璃是由纯碱、石灰石和石英制成的,其熔点很高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】日本产业技术综合研究所发布的锂空气电池的设计构思是负极采用金属锂条,中间设有用于隔开正极和负极的锂离子固体电解质,正极的水性电解液使用碱性水溶性凝胶,与由微细化碳和廉价氧化物催化剂形成的正极组合,既可以用作充电电池也可用作燃料电池使用,结构如图所示。下列有关该锂空气电池说法不正确的是( )
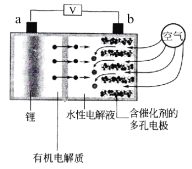
A.电池放电时,Li+穿过隔膜向b极移动得到LiOH溶液
B.放电时,外电路的电子由a经外电路流向b
C.充电时,a电极的电极反应为:Li+ + e- ═ Li
D.放电时,b极发生的电极反应为O2 - 4e- + 2H2O ═ 4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 若将等质量的硫蒸气和硫固体分别完全燃烧,前者放出热量多
B. C(s,石墨)= C(s,金刚石) ΔH﹦+1.5kJ/mol,结论:相同条件下金刚石性质比石墨稳定
C. CH4(g) + 2O2(g)=CO2(g) + 2H2O(g) △H﹦-801.3kJ/mol, 结论:CH4的燃烧热△H﹦-801.3kJ/mol
D. N2(g) + 3H2(g)![]() 2NH3(g) ΔH﹦-92.4kJ/mol,结论:在密闭容器中充入0.5molN2、1.5molH2,充分反应后放出46.2kJ的热量
2NH3(g) ΔH﹦-92.4kJ/mol,结论:在密闭容器中充入0.5molN2、1.5molH2,充分反应后放出46.2kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组探究SO2气体的还原性,装置如图所示,下列说法不合理的是
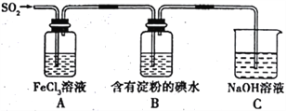
A. A装置中FeCl3溶液逐渐变为浅绿色,可以说明SO2有还原性
B. B装置中蓝色退去,说明还原性:SO2>I-
C. C装置中吸收尾气有可能倒吸
D. A、B装置中发生的反应转移电子数一定相等。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com