
【题目】已知反应![]()
![]()
![]()
![]() 。一定条件下,向容积为
。一定条件下,向容积为![]() 的密闭容器中充入
的密闭容器中充入![]() 和
和![]() ,测得
,测得![]() 和
和![]() 的浓度随时间变化的曲线如图所示。下列叙述中正确的是( )
的浓度随时间变化的曲线如图所示。下列叙述中正确的是( )
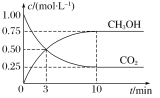
A.升高温度能使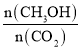 增大
增大
B.反应达到化学平衡时,![]() 的转化率为75%
的转化率为75%
C.![]() 时,用
时,用![]() 表示的正反应的反应速率等于用
表示的正反应的反应速率等于用![]() 表示的逆反应的反应速率
表示的逆反应的反应速率
D.从反应开始到反应达到平衡状态,![]() 的平均反应速率
的平均反应速率![]()
 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
A.图表示反应2SO2 (g)+O2(g)![]() 2SO3 (g) ΔH<0不同温度(T1<T2)时平衡常数K随压强的变化关系图
2SO3 (g) ΔH<0不同温度(T1<T2)时平衡常数K随压强的变化关系图
B.图曲线表示电解精炼铜过程中电极质量的变化
C.图曲线表示反应N2(g)+3H2(g)![]() 2NH3(g)在t1时刻增大压强后v(正)、v(逆)随时间的变化
2NH3(g)在t1时刻增大压强后v(正)、v(逆)随时间的变化
D.图曲线表示0.1000 mol·L—1 NaOH溶液滴定20.00 mL pH=1的CH3COOH溶液所得溶液的pH随NaOH溶液体积的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu(OH)2在水溶液中存在着如下沉淀溶解平衡:Cu(OH)2(s) Cu2+(aq)+2OH-(aq),在常温下Ksp=2×10-20。在常温下如果要生成Cu(OH)2沉淀,需要向0.02mol/L的CuSO4溶液中加入碱来调整溶液的pH,应使溶液的pH大于( )
A.3B.4C.5D.6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个体积为5 L的真空密闭容器中加入1.25 mol CaCO3,发生反应CaCO3 (s)![]() CaO(s) +CO2(g),测得平衡时二氧化碳的物质的量浓度随温度的变化关系如图所示:
CaO(s) +CO2(g),测得平衡时二氧化碳的物质的量浓度随温度的变化关系如图所示:
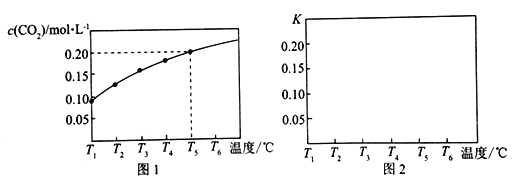
请按要求回答下列问题:
(1)该反应正反应为__________热反应(填“吸”或“放”),温度为T5℃时,该反应耗时40s达到平衡,则T5℃时,该反应的平均反应速率为________________。
(2)T2℃时,该反应已经达到平衡,下列措施中能使该反应的平衡常数K值变大的是_______________(选填编号)。
a.减小压强 b.减少CaO的量 c.加入CaCO3 d.升高温度
(3)请在如图中画出平衡常数K随温度的变化曲线_______________。
(4)在T5℃下,维持温度和容器体积不变,向上述平衡体系中再充入1molN2,则最后平衡时容器中的CaCO3的质量为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以镍废料(主要成分为镍铁合金,含少量铜)为原料,生产NiO的部分工艺流程如下:
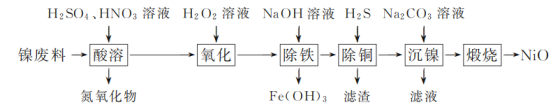
已知:下表列出了几种金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.7 |
沉淀完全的pH | 3.3 | 9.9 | 9.2 |
(1)“除铁”时需控制溶液的pH范围为________。
(2)“滤渣”的主要成分为________(填化学式)。
(3)“沉镍”时得到碱式碳酸镍[用xNiCO3·yNi(OH)2表示]沉淀。
①在隔绝空气条件下,“煅烧”碱式碳酸镍得到NiO,该反应的化学方程式为________。
②“沉镍”时,溶液pH增大,碱式碳酸镍中Ni元素含量会增加,原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2H2(g)+O2(g)===2H2O(l) ΔH=-571.6kJ·mol-1
CO(g)+1/2O2(g)===CO2(g) ΔH=-282.8kJ·mol-1
现有CO、H2、CO2组成的混合气体67.2L(标准状况),经完全燃烧后放出的总热量为710.0kJ,并生成18g液态水,则燃烧前混合气体中CO的体积分数为( )
A. 80% B. 50% C. 60% D. 20%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的资源化利用能有效减少CO2排放,充分利用碳资源。
(3)CO2催化加氢合成二甲醚是一种CO2转化方法,其过程中主要发生下列反应:
反应Ⅰ:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH =41.2 kJ·mol1
CO(g)+H2O(g) ΔH =41.2 kJ·mol1
反应Ⅱ:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) ΔH =﹣122.5 kJ·mol1
CH3OCH3(g)+3H2O(g) ΔH =﹣122.5 kJ·mol1
在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图。其中:CH3OCH3的选择性=![]() ×100%
×100%
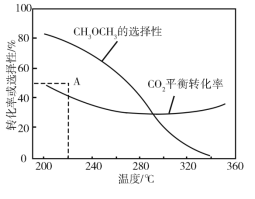
①温度高于300 ℃,CO2平衡转化率随温度升高而上升的原因是________。
②220 ℃时,在催化剂作用下CO2与H2反应一段时间后,测得CH3OCH3的选择性为48%(图中A点)。不改变反应时间和温度,一定能提高CH3OCH3选择性的措施有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关能量的叙述不正确的是
A.H2(g)的燃烧热是H=-285.8kJ/mol,则反应2H2O(g)=2H2(g)+O2(g)的反应热H=+571.6kJ/mol
B.化学键的断裂和形成是物质在化学变化中能量变化的主要原因
C.活化能的大小对化学反应前后的能量变化不产生影响
D.化学反应过程中同时存在物质变化和能量的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为几种晶体或晶胞的示意图:


请回答下列问题:
(1)上述晶体中,粒子之间以共价键结合形成的晶体是____。
(2)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为:___。
(3)NaCl晶胞与MgO晶胞相同,NaCl晶体的晶格能___(填“大于”或“小于”)MgO晶体,原因是____。
(4)每个Cu晶胞中实际占有___个Cu原子,CaCl2晶体中Ca2+的配位数为__。
(5)冰的熔点远高于干冰,除H2O是极性分子、CO2是非极性分子外,还有一个重要的原因是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com