
(1)已知N≡N、N﹣H、H﹣H的键能分别为946kJ•mol﹣1、390.8kJ•mol﹣1、436.0kJ•mol﹣1.试根据盖斯定律,写出合成氨反应的热化学方程式 .
(2)在通常状况下,足量氢氧化钠的稀溶液与含溶质为1mol的稀硫酸完全反应时放出akJ的热量,写出该反应中和热的热化学方程式
(3)以镁和铝为电极,以NaOH作电解质溶液,构成原电池时,铝做负极,电极反应式为 ;
与MnO2﹣Zn电池类似,K2FeO4﹣Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为 ,该电池总反应的离子方程式为 .
考点: 热化学方程式;原电池和电解池的工作原理.
分析: (1)反应热=反应物键能之和﹣生成物中键能之和,利用化学计量数关系分析熵变;
(2)中和热是强酸强碱发生反应生成1mol水放出的热量,据此书写热化学方程式,1mol的稀硫酸含有2molH+,全部反应生成2mol水;
(3)以镁条、铝片为电极,以NaOH溶液为电解质溶液设计的原电池中,相对于电解质溶液来讲,铝更活泼,原电池的总反应一般是负极和电解质溶液的反应,K2FeO4﹣Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,负极为锌失电子发生氧化反应,电极反应Zn﹣2e﹣+2OH﹣=Zn(OH)2;依据产物和电子守恒写出正极反应:FeO42﹣+3eˉ+4H2O→Fe(OH)3+5OHˉ;有正极反应和负极反应合并得到电池反应.
解答: 解:(1)N≡N的键能是946kJ/mol,H﹣H的键能为436kJ/mol,N﹣H的键能为390.8kJ/mol,则
N2(g)+3H2(g)⇌2NH3(g)△H=946kJ/mol+3×436kJ/mol﹣6×390.8kJ/mol=﹣90.8kJ/mol,
该热化学方程式为N2(g)+3H2(g)⇌2NH3(g)△H=﹣90.8 kJ/mol,
故答案为:N2(g)+3H2(g)⇌2NH3(g)△H=﹣90.8kJ/mol
(2)在通常状况下,足量氢氧化钠的稀溶液与含溶质为1mol的稀硫酸完全反应时放出akJ的热量,1mol的稀硫酸含有2molH+,全部反应生成2mol水,生成1mol水放热 KJ,中和热的热化学方程式为:NaOH(aq)+
KJ,中和热的热化学方程式为:NaOH(aq)+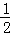 H2SO4(aq)=
H2SO4(aq)=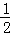 Na2SO4(aq)+H2O(l)△H=﹣
Na2SO4(aq)+H2O(l)△H=﹣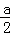 kJ/mol;
kJ/mol;
故答案为:NaOH(aq)+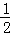 H2SO4(aq)=
H2SO4(aq)=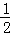 Na2SO4(aq)+H2O(l)△H=﹣
Na2SO4(aq)+H2O(l)△H=﹣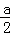 kJ/mol;
kJ/mol;
(3)以镁条、铝片为电极,以NaOH溶液为电解质溶液设计的原电池中,相对于电解质溶液NaOH溶液来讲,铝更活泼,故铝做负极,原电池的总反应一般是负极和电解质溶液的反应,故反应方程式为:2Al+2H2O+2NaOH=2NaAlO2+3H2↑,负极电极反应为:Al﹣3e+4OH﹣=2H2O+AlO2﹣,原电池的负极发生氧化反应,正极电极反应式为:①FeO42﹣+3eˉ+4H2O=Fe(OH)3+5OH﹣;负极电极反应为:②Zn﹣2e﹣+2OH﹣=Zn(OH)2;依据电极反应的电子守恒,①×2+②×3合并得到电池反应为:3Zn+2FeO42﹣+8H2O=3Zn(OH)2+2Fe(OH)3+4OH﹣,
故答案为:负;Al﹣3e+4OH﹣=2H2O+AlO2﹣;FeO42﹣+3e﹣+4H2O=Fe(OH)3+5OH﹣;3Zn+2FeO42﹣+8H2O=2Fe(OH)3+4OH﹣+3Zn(OH)2.
点评: 本题考查了氧化还原反应、原电池的工作原理的应用、电极反应式的书写等,题目难度中等,熟悉氧化还原反应的规律、原电池的工作原理是解题关键,注意培养阅读材料获取信息的能力.


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
下列各溶液中,Na+浓度最大的是( )
|
| A. | 5L 1.2mol•L﹣1的Na2SO4溶液 |
|
| B. | 2L 0.8mol•L﹣1的NaOH溶液 |
|
| C. | 1L 1mol•L﹣1的Na2CO3溶液 |
|
| D. | 4L 0.5mol•L﹣1的NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)同温同压下,同体积的甲烷(CH4)和二氧化碳分子数之比为 ,物质的量之比为 ,原子总数之比为 ,密度之比为 .
(2)在标准状况下,4g H2、11.2L O2、1mol H2O中,所含分子数最多的是 ,含原子数最多的是 ,体积最小的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知:pM=﹣lgc(M),p(CO32﹣)=﹣lgc(CO32﹣).下列说法正确的是()
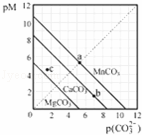
A. MgCO3、CaCO3、MnCO3的Ksp依次增大
B. a点可表示MnCO3的饱和溶液,且c(Mn2+)<c(CO32﹣)
C. b点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32﹣)
D. c点可表示MgCO3的不饱和溶液,且c(Mg2+)<c(CO32﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数的值,下列说法正确的是()
A. 电解硫酸时,阴极产生1molH2时,阳极一定产生0.5molO2
B. 盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5mol
C. 电解1mol熔融的Al2O3,能产生33.6L氧气、54.0g金属铝
D. 工业用电解法进行粗铜精炼时,每转移1mol电子,阳极上就溶解0.5NA个铜原子
查看答案和解析>>
科目:高中化学 来源: 题型:
关于化学键的下列叙述中,正确的是( )
|
| A. | 离子化合物一定含共价键 |
|
| B. | 共价化合物可能含离子键 |
|
| C. | 离子化合物中只含离子键 |
|
| D. | 共价化合物中肯定不含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
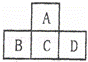
有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素的原子核外共有56个电子,在周期表中的位置如图所示.E元素的最高价氧化物既能与强酸反应又能与强碱反应.请回答:
(1)写出下列元素的元素符号:A 、B 、D .
(2)A元素与氢元素形成的H2A化合物分子中,所含化学键为 键(填“离子”或“极性”或“非极性”),用电子式表示H2A的形成过程 , .
(3)A元素与E元素形成的化合物的化学式是 ,该化合物在物质分类中属于 氧化物.(填“酸性”,“碱性”或“两性”)
(4)向D元素与E元素形成的化合物的水溶液中滴加NaOH溶液,开始时,实验现象是 有 ,反应的离子方程式为 ;继续滴加NaOH溶液至过量,实验现象是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,盐酸溶液的pH是4,氯化铵溶液的pH是5,盐酸与氯化铵溶液中水电离的c(H+)之比为()
A. 10:1 B. 1:10 C. 1:105 D. 105:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com