
| A. | 乙烯通入溴水中 | |
| B. | 乙烯通入酸性高锰酸钾溶液中 | |
| C. | 在水浴加热的条件下,苯与浓硝酸和浓硫酸混合液的反应 | |
| D. | 在镍做催化剂的条件下,苯与氢气反应 |
分析 A.乙烯与溴水发生加成反应;
B.乙烯被高锰酸钾氧化;
C.苯中H被硝基取代;
D.苯与氢气发生加成反应生成环己烷.
解答 解:A.乙烯通入溴水中,生成1,2-二溴乙烷,为加成反应,故A不选;
B.乙烯通入酸性高锰酸钾溶液中,生成二氧化碳,为氧化反应,故B不选;
C.在水浴加热的条件下,苯与浓硝酸和浓硫酸混合液的反应,生成硝基苯,为取代反应,故C选;
D.在镍做催化剂的条件下,苯与氢气反应,生成环己烷,为加成反应,故D不选;
故选C.
点评 本题考查有机物的结构与性质,为高考常见题型,把握官能团与性质的关系、有机反应为解答的关键,侧重分析与应用能力的考查,注意有机反应的判断,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 化合反应均为氧化还原反应 | B. | 金属氧化物均为碱性氧化物 | ||
| C. | 烧碱、纯碱、熟石灰都是碱 | D. | BaSO4、NaOH、HNO3都是强电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
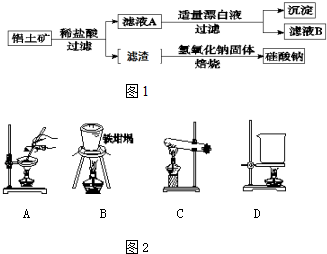
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应释放或吸收能量的多少与发生反应的反应物的物质的量有关 | |
| B. | 人们可以利用氧化还原反应设计原电池以获取电能 | |
| C. | 人们可以利用C2H2(乙炔)与O2的化学反应获取热能或电能或光能 | |
| D. | MnO4-+5e-+8H+═Mn2++4H2O可能是某原电池里的负极反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| B. | NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-═NH3↓+H2 | |
| C. | 向次氯酸钙溶液通入过量CO2:Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO | |
| D. | 硫酸氢铵与少量氢氧化钠溶液混合:NH4++HSO4-+2OH-═SO42-+NH3↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题


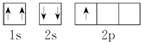
| A. | ①②③ | B. | ②③④ | C. | ①②④⑤ | D. | 只有③ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
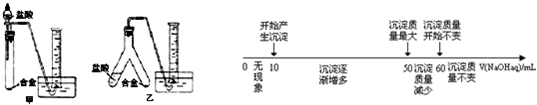
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有① | B. | 只有③ | C. | ①②③的混合物 | D. | ①②③④的混合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com