
| KMnO4酸性溶液 的浓度/mol•L-1 | 溶液褪色所需时间t/min | ||
| 第1次 | 第2次 | 第3次 | |
| 0.01 | 14 | 13 | 11 |
| 0.001 | 6 | 7 | 7 |
分析 (1)高锰酸钾具有强氧化性,能将草酸氧化为二氧化碳,本身被还原为锰离子,据此书写离子方程式;
(2)先求出反应开始时c(KMnO4),然后求出三次褪色的平均时间,最后根据ν(KMnO4)=$\frac{△c}{△t}$进行计算;
(3)因颜色是由KMnO4产生,虽然KMnO4浓度大反应快,但KMnO4的量也多,故无法比较.
解答 解:(1)高锰酸钾具有强氧化性,能将草酸氧化为二氧化碳,本身被还原为锰离子,离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,
故答案为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
(2)反应开始时:c(KMnO4)=$\frac{0.001mol/L×0.004L}{0.004L+0.002L}$=0.00067 mol•L-1
反应时间:△t=$\frac{6min+7min+7min}{3}$=6.7min
KMnO4的平均反应速率v(KMnO4)=$\frac{△c}{△t}$=$\frac{0.00067mol/L}{6.7min}$=1×10-4 mol/(L•min)
故答案为:1×10-4 mol/(L•min);
(3)由题中数据知浓度大的褪色时间反而长,因颜色是由KMnO4产生,虽然KMnO4浓度大反应快,但KMnO4的量也多,故无法比较,故不经过计算直接利用表中的褪色时间长短来判断浓度大小与反应速率的关系是不可行的,
故答案为:不行.
点评 本题考查了影响化学反应速率的因素,侧重于学生的分析、实验能力的考查,难度不大,熟练掌握外界条件对化学反应速率的影响为解答关键.


科目:高中化学 来源: 题型:选择题
 将两种两种气态烃组成的混合气体完全燃烧,得到CO2和H2O的物质量与混合烃的物质的置的关系如图所示.
将两种两种气态烃组成的混合气体完全燃烧,得到CO2和H2O的物质量与混合烃的物质的置的关系如图所示.| A. | ②③⑤ | B. | ⑤⑥ | C. | ②④⑥ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.2 LNH3所含分子数为0.5NA | |
| B. | 1molCl2与足量Fe反应,转移的电子数为3NA | |
| C. | 23g金属钠与氧气加热生成Na2O2的反应,转移的电子数为2NA | |
| D. | 5.6g铁与足量的盐酸反应,失去的电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
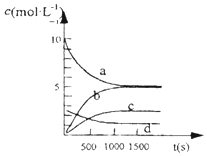 (1)已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ/mol
(1)已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ/mol| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(ml) | 20 | 13.96 | 10.08 | 10.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
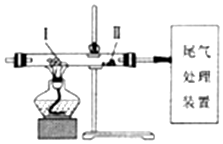
| A. | 缓慢通入N2,再加热Ⅰ处的碳酸氢钠,可观察到Ⅱ处过氧化钠粉末由浅黄色变成白色 | |
| B. | 缓慢通入N2,加热Ⅰ处KClO3和MnO2的混合物,可观察到Ⅱ处干燥KI淀粉试纸变成蓝色 | |
| C. | 先对Ⅰ处的氯化铵加热,再缓慢通入N2,可看到Ⅰ处固体减少,Ⅱ处无固体沉积 | |
| D. | 先缓慢通入CO2,再加热Ⅰ处炭粉,可观察到Ⅱ处氧化铁粉末由红色变成黑色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类、油脂和蛋白质均是高分子化合物 | |
| B. | 雾能产生丁达尔效应,雾属于胶体 | |
| C. | 新制氯水、HClO和SO2都有漂白作用 | |
| D. | 硝酸能与苯发生取代反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com