
| 实验次数 | 混合物的质量/g | 所加Ba(OH)2溶液的体积/L | 测得沉淀的质量/g |
| 1 | 1.716 | 0.5 | 2.758 |
| 2 | 3.432 | 0.5 | |
| 3 | 5.148 | 0.5 | 8.274 |
| 4 | 6.864 | 0.5 | 11.032 |
| 5 | 8.580 | 0.5 | 11.032 |
| 6 | 10.296 | 0.5 | 11.032 |
分析 (1)根据第1次与第2次样品之比等于沉淀质量之比,据此计算第2次生成沉淀的质量;
(2)实验中每次滴加相同浓度的Ba(OH)2溶液500mL,第4次、第5次、第6次生成沉淀碳酸钡质量都为11.032g,说明样品质量为6.864g时,氢氧化钡已经完全反应,碳酸钡的物质的量为$\frac{11.032g}{197g/mol}$=0.056mol,根据钡离子守恒可知氢氧化钡的物质的量为0.056mol,据此计算;
(3)第3次实验中样品完全反应,令碳酸氢钠与碳酸钾的物质的量分别为xmol、ymol,根据碳元素守恒可知沉淀碳酸钡的物质的量为(x+y)mol,根据样品质量与碳酸钡沉淀质量列方程计算;
(4)第3组实验,反应后溶液为氢氧化钡、氢氧化钠、氢氧化钾的混合溶液,由钡离子守恒计算n[Ba(OH)2],根据钠离子、钾离子守恒计算n(NaOH)、n(KOH),进而计算溶液的$\frac{1}{10}$中含有n(OH-),再根据c=$\frac{n}{v}$计算,故c(H+)=$\frac{kw}{c(O{H}^{-})}$,并据pH=-lgc(H+)进行计算.
解答 解:(1)第2次实验中样品完全反应,设产生沉淀质量为mg,则1.716g:3.432g=2.758:mg,解得m=5.516,
故答案为:5.516;
(2)实验中每次滴加相同浓度的Ba(OH)2溶液500mL,第3次、第4次生成沉淀碳酸钡质量都为5.516g,说明样品质量为3.342g时,氢氧化钡已经完全反应,碳酸钡的物质的量为$\frac{11.032g}{197g/mol}$=0.056mol,根据钡离子守恒可知氢氧化钡的物质的量为0.056mol,所以Ba(OH)2溶液中溶质的物质的量浓度是$\frac{0.056mol}{0.5L}$=0.112mol/L,
故答案为:0.112;
(3)第3次实验中样品完全反应,设碳酸氢钠与碳酸钾的物质的量分别为xmol、ymol,根据碳元素守恒可知沉淀碳酸钡的物质的量为:(x+y)mol,则:84x+138y=5.148g、197x+197y=8.274,
解得:x=0.012,y=0.03,
故样品中K2CO3和NaHCO3的物质的量之比为0.03mol:0.012mol=5:2,
故答案为:5:2;
(4)第3组实验,反应后溶液为氢氧化钡、氢氧化钠、氢氧化钾的混合溶液,由钡离子守恒:n[Ba(OH)2]=0.056mol-$\frac{8.274g}{197g/mol}$=0.014mol,根据钠离子守恒:n(NaOH)=n(NaHCO3)=0.012mol,根据钾离子守恒:n(KOH)=2n(K2CO3)=0.03mol×2=0.06mol,所以溶液中n总(OH-)=2n[Ba(OH)2]+n(NaOH)+n(KOH)=0.014mol×2+0.012mol+0.06mol=0.1mol,取所得溶液体积的$\frac{1}{10}$,含有的氢氧根的物质的量为0.01mol,加水配成1000mL溶液,c(OH-)=$\frac{0.01mol}{1L}$=0.01mol/L,故c(H+)=$\frac{kw}{c(O{H}^{-})}$=$\frac{1{0}^{-14}}{0.01}$=10-12,pH=-lgc(H+)=-lg10-12=12,
故答案为:12.
点评 本题考查混合物的计算、实验数据分析处理等,综合性较大,根据质量定比关系判断过量问题是解题关键,旨在考查学生的综合能力,是一道不错的能力考查题,题目难度较大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
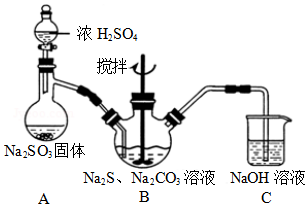
| 实验次数 | 样品溶液体积(mL) | 滴定消耗0.100mol/L碘溶液体积(mL) |
| 1 | 20.00 | 9.80 |
| 2 | 20.00 | 10.70 |
| 3 | 20.00 | 9.90 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
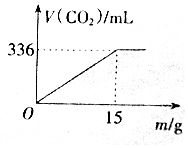 一定质量的铁碳合金在足量的氧气中燃烧,合金质量与生存二氧化碳体积(已换算为标准状况)关系如图所示,则此铁碳合金是( )
一定质量的铁碳合金在足量的氧气中燃烧,合金质量与生存二氧化碳体积(已换算为标准状况)关系如图所示,则此铁碳合金是( )| A. | 低碳钢 | B. | 中碳钢 | C. | 高碳钢 | D. | 合金钢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘是人体内必须的微量元素,所以富含高碘酸的食物适合于所有人群 | |
| B. | 化石燃料不完全燃烧会产生CO造成污染,完全燃烧不会造成大气污染 | |
| C. | 利用铁比铜金属性强的性质,常用FeCl3溶液腐蚀Cu来刻制印刷电路板 | |
| D. | 中国古代利用明矾溶液清除铜镜表面的铜镑,是利用了明矾溶液的酸性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com