
| A、1molCl2与足量的铁反应,转移电子数为3NA |
| B、常温常压下,1mol氦气含有的原子数为NA |
| C、标准状况下,2.24L丁烷分子所含的C-H 键数为NA |
| D、1molNa2O2所含的阴离子数目为NA |


 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
c(N
| ||
| c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||||||||||
| B、汽车尾气催化转化装置可将尾气中的NO和CO等有害气体转化为N2和CO2,该装置中的催化剂可降低NO和CO反应的活化能,有利于提高该反应的平衡转化率 | ||||||||||
| C、能量是可以互相转化的.植物的光合作用可将太阳能转变成化学能,单晶硅可将光能转变成电能.原电池和电解池可实现化学能和电能的相互转换 | ||||||||||
| D、乳酸分子中既有羟基又有羧基,因此可在一定条件下缩聚得到聚乳酸(PLA).该高分子化合物是一种可降解的环保材料. |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、e是稀硫酸,c、d是金属Cu,在AB两端接上一个电流表,可看到电流表指针偏转 |
| B、用该装置做Fe片表面电镀Cu的实验,c、d是Fe片和Cu片,e是CuSO4溶液,A、B接直流电源的正负极 |
| C、c、d都用石墨,e为CuCl2溶液,A、B分别连接直流电源正、负极,c极反应式为:2Cl--2e-=Cl2↑ |
| D、c、d分别用Zn和Fe,e是经过酸化的3% NaCl溶液,AB两端接电流表是验证牺牲阳极的阴极保护法实验装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、0.5mol雄黄(As4S4,结构如图)含有NA个S-S键 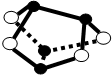 |
| B、1mol/L(NH4)2SO4溶液中,含SO42-NA个,NH4+少于2NA个 |
| C、23g钠与一定量的氧气作用,若两者均无剩余,转移NA个电子 |
| D、将含0.1 mol FeCl3的溶液滴加到沸水中完全水解可生成0.1 NA个Fe(OH)3胶粒 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加强海底可燃冰、锰结核的探测与开发研究 |
| B、将地沟油回收利用生产生物柴油,变废为宝 |
| C、在生产、流通和消费等过程中实行“减量化、再利用、资源化” |
| D、电镀废液经中和后排放灌溉农田,提高水的利用率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
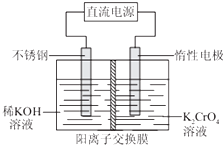 以铬酸钾(K2CrO4)为原料,用电化学法制备重铬酸钾(K2Cr2O7)的实验装置如图所示,其反应原理可表示为4K2CrO4+4H2O
以铬酸钾(K2CrO4)为原料,用电化学法制备重铬酸钾(K2Cr2O7)的实验装置如图所示,其反应原理可表示为4K2CrO4+4H2O
| ||
| A、在阴极室,随着反应的进行溶液的pH逐渐变小 |
| B、惰性电极上发生的电极反应为4OH--4e-═2H2O+O2↑ |
| C、惰性电极上得到H2,不锈钢电极上生成O2 |
| D、惰性电极应连接直流电源的负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 水是组成生命体的重要化学物质,有关水的反应又很多.
水是组成生命体的重要化学物质,有关水的反应又很多.
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com