
【题目】焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。已知:① 装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2===Na2S2O5;
② Na2S2O5晶体在空气中被氧化生成Na2SO4。
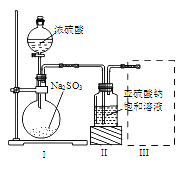
(1) 装置Ⅰ中产生气体的化学方程式为:_____________________________。
(2) 要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是 。
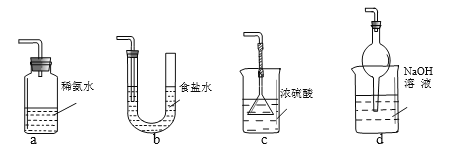
(3) 装置Ⅲ用于处理尾气,可选用右图中最合理装置(夹持仪器已略去)为___________(填序号)。
(4)检测Na2S2O5晶体在空气中已被氧化的实验方案是: 。
(5)为了研究Cl2与SO2的在干燥条件下发生反应及进行的程度。用右下图所示装置收集满干燥的Cl2,再通入干燥的SO2,集气瓶中立即出现无色液体SO2Cl2; 充分反应后,将液体和剩余气体分离。用除尽空气的NaOH溶液吸收分离出的气体,用足量稀盐酸酸化后,再滴加BaCl2溶液,产生白色沉淀,该白色沉淀是 ,由此可知反应后剩余的气体为Cl2和 ,综合实验信息,干燥的SO2与Cl2反应的化学方程式为 。

【答案】(1)(1分)Na2SO3+H2SO4===Na2SO4+SO2↑+H2O
(2)(1分)过滤(3)(1分)d(多选0分)
(4)(3分)取少量Na2S2O5晶体于适量水的试管中(1分),滴加足量盐酸振荡,再滴入氯化钡溶液(1分),有白色沉淀生成,则该晶体已被氧化(1分)
(5)(4分)BaSO4(1分) SO2(1分) SO2+Cl2![]() SO2Cl2 (2分)
SO2Cl2 (2分)
【解析】
试题分析:(1)由装置Ⅱ中发生的反应可知,装置Ⅰ中产生的气体为SO2,亚硫酸钠与硫酸反应生成硫酸钠、二氧化硫与水,反应方程式为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
(2)装置Ⅱ中获得已析出的晶体,分离固体与液态,应采取过滤进行分离;
(3)a.装置应将导管深入氨水中可以吸收二氧化硫,但为密闭环境,装置内压强增大易产生安全事故,故错误;b.该装置吸收二氧化硫能力较差,且为密闭环境,装置内压强增大易产生安全事故,故错误;c.该装置不能吸收二氧化硫,所以无法实现实验目的,故错误;d.该装置中氢氧化钠与二氧化硫反应,可以吸收,且防止倒吸,故正确;故答案为d;
(4)Na2S2O5中S元素的化合价为+4价,因此会被氧化为为+6价,即晶体在空气中易被氧化为Na2SO4,用盐酸、氯化钡溶液检验样品中是否含有硫酸根即可,实验方案为:取少量Na2S2O5晶体于试管中,加入适量水溶解,滴加盐酸,振荡,再滴加氯化钡溶液,有白色沉淀生成;
(5)生成的白色沉淀为BaSO4,说明NaOH溶液吸收分离出的气体成分不是单一的SO2或Cl2,而是二者的混合气体,在水溶液里发生了氧化还原反应,生成了硫酸根离子,同时也可知SO2与Cl2生成SO2Cl2的反应是可逆反应,因为反应物的转化率没有达到100%,反应方程式为SO2+Cl2![]() SO2Cl2。
SO2Cl2。


科目:高中化学 来源: 题型:
【题目】抗酸药有效成分有:碳酸氢钠、碳酸钙、碳酸镁、氢氧化铝、氢氧化镁等,请写出胃酸与氢氧化铝反应的化学方程式____________________________________________;再写出碳酸氢钠与胃酸反应的离子方程式_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A.氯水中有下列平衡Cl2+H2O![]() HCl+HClO,光照后,溶液颜色变浅
HCl+HClO,光照后,溶液颜色变浅
B.合成氨反应,为提高氨的产率,理论上应采取较低的温度
C.用饱和食盐水除去Cl2中的HCl
D.反应2HI(g)![]() H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能用2H++ CO32-= H2O + CO2↑表示的是
A. CH3COOH和Na2CO3的反应 B. H2SO4和碳酸氢钠的反应
C. K2CO3和NaHSO4反应 D. 碳酸钙和稀盐酸的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硅及其化合物的描述不正确的是
A.SiO2可用于制造光导纤维
B.H2SiO3可以用二氧化硅和水反应制得
C.普通玻璃是以纯碱、石灰石和石英为原料制成的
D.盛装NaOH溶液的试剂瓶不用玻璃塞是因为玻璃塞与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KClO3和浓盐酸在一定温度下发生如(1)的反应:
(1)请配平方程式,并用双线桥表示得失电子情况:
_____KClO3+______HCl(浓)=______KCl+______ClO2↑+______Cl2↑+______H2O
(2)氧化剂是_________,还原产物是_________(写化学式)。
(3)产生0.1molCl2时,转移电子的物质的量为__________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与应用相对应的是( )
A. BaCO3能与盐酸反应,可用于治疗胃酸过多
B. MgO熔点高,可用作耐高温材料
C. SO2具有氧化性,可用于漂白品红、织物等
D. NH3极易溶于水,可用作制冷剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是
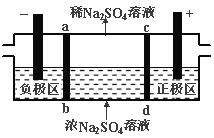
A.通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C.负极反应为2 H2O-4e–=O2+4H+,负极区溶液pH降低
D.当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com