
下列实验能达到相应目的的是
A. 用乙醇萃取溴水中的溴单质
B. 用干燥的pH试纸测定新制氯水的pH
C. 向NH4Cl溶液中滴加石蕊试液,溶液变红,证明NH4Cl发生了水解反应
D. 向蒸馏水中滴加过量的饱和FeCl3溶液,并不断搅拌,制取Fe(OH)3胶体
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2017届河南省洛阳市高三第二次统一考试(3月)理综化学试卷(解析版) 题型:实验题
亚硝酸钠是一种工业盐,外观与食盐非常相似,毒性较强。
Ⅰ.经查:①Ksp(AgNO2)=2×10-8,Ksp(AgCl)=1.8×10-10;②Ka(HNO2)=5.1×10-4。请设计最简单的方法鉴别NaNO2和NaCl两种固体______________________
Ⅱ. 某小组同学用如下装置(略去夹持仪器)制备亚硝酸钠

已知:①2NO+Na2O2=2NaNO2; ②酸性条件下,NO和NO2都能与MnO4-反应生成NO3-和Mn2+。
(1)使用铜丝的优点是________________________。
(2)装置A中发生反应的化学方程式为_____________________________。
装置C中盛放的药品是_________;(填字母代号)
A.浓硫酸 B.NaOH溶液 C.水 D.四氯化碳
(3)该小组称取5.000g制取的样品溶于水配成250ml溶液,取25.00ml溶液于锥形瓶中,
用0.1000mol·L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
滴定次数 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积/mL | 20.90 | 20.12 | 20.00 | 19.88 |
①第一次实验数据出现异常,造成这种异常的原因可能是_________(填字母代号)。
a.锥形瓶洗净后未干燥
b.酸式滴定管用蒸馏水洗净后未用标准液润洗
c.滴定终点时仰视读数
②酸性KMnO4溶液滴定亚硝酸钠溶液的离子方程式为___________________。
③该样品中亚硝酸钠的质量分数为______________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高一下学期开学考试化学试卷(解析版) 题型:实验题
某同学设计了如下装置用于制取SO2并验证SO2的部分性质。回答下列问题:
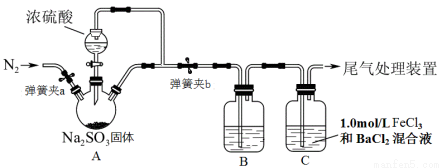
(1)装置A中用于添加浓硫酸的仪器名称为 。
(2)某同学为了检验装置中A、B两部分的气密性,进行的操作是:关闭弹簧夹a、打开弹簧夹b,用酒精灯在三口烧瓶下微热,观察到C中长导管口有明显气泡现象,他判断气密性良好。你认为是否合理________。(填“合理”或“不合理”)
(3)实验前要在装置中鼓入N2,目的是 。
(4)为了验证SO2是酸性氧化物,B中可选用的试剂是( )
A.无色酚酞溶液 B.蓝色石蕊试液
C.红色品红溶液 D.KI淀粉混合溶液
(5)装置C中可观察到白色沉淀现象,由此可验证SO2具有 性,相关反应的离子方程式_______。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高一下学期开学考试化学试卷(解析版) 题型:选择题
在下列各溶液中,离子一定能大量共存的是( )
A. 强碱性溶液中:K+、Al3+、Cl-、SO42-
B. 含有0.1 mol•L-1 Fe3+的溶液中:K+、Mg2+、I-、NO3-
C. 含有0.1 mol•L-1 Ca2+的溶液中:Na+、K+、CO32-、Cl-
D. 室温下,pH=1的溶液中:Na+、Fe3+、NO3-、SO42-
查看答案和解析>>
科目:高中化学 来源:2017届广西省桂林市、崇左市高三联合调研考试理科综合化学试卷(解析版) 题型:实验题
四氯化钛(TiCl4)是制取航天工业材料——钛合金的重要原料。实验室以TiO2和CCl4为原料树取液态TiCl4的装置如图所示(部分夹持装置省略)。

已知:有关物质的性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 其他 |
CCl4 | -23 | 76 | 与TiCl4互溶 |
TiCl4 | -25 | 136 | 遇潮湿空气产生白雾,在550 ℃时能被氧气氧化 |
请回答下列问题:
(1)仪器A的名称是________,仪器A中盛装的试剂是___________。
(2)CCl4的电子式为__________。
(3)装置C处硬质玻管中反应的化学方程式为__________________。
(4)TiCl4遇潮湿空气会产生TiO2,反应的化学方程式为________________。
(5)仪器N中收集到的物质主要有___________(写化学式),从产物中分离出TiCl4的实验方法是_____________。
(6)TiCl4还可由TiO2、焦炭和氯气在加热条件下制得,生成体积比为2∶1的CO和CO2混合气体,该反应中氧化剂与还原剂的物质的量之比为________。请设计实验方案验证产物气体中有CO:_______________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省马鞍山市高二理科创新人才实验班招生考试化学试卷(解析版) 题型:简答题
硫的化合物种类较多,用途广泛。
I:焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一,其制备的反应原理为:Na2SO3+ SO2==Na2S2O5
某研究小组利用下图装置制取Na2S2O5,盛硫酸的仪器叫分液漏斗。
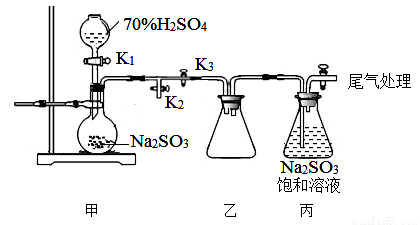
(1)写出装置甲中发生反应的化学方程式__________________。
(2)关闭K3,要求只检查装置甲的气密性,请至少写出两种不同的操作方法。
方法1:_________________________。
方法2:_________________________。
方法3:_________________________。
(3)装置乙的作用是________________。
(4)写出焦亚硫酸钠晶体在空气中被完全氧化的化学方程式_____________。
II:硫化氢的转化是资源利用和环境保护的重要研究课题。将H2S和空气的混合气体通入FeCl3 、FeCl2、CuCl2的混合溶液中反应用以回收S,其物质转化如图所示。
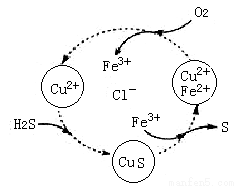
(1)反应中当有34gH2S转化为硫单质时,保持溶液中Fe3+的量不变,需要消耗O2的质量为 _____________。
(2)在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施是___________________。
(3)写出图中各步转化的化学方程式:____________________。
查看答案和解析>>
科目:高中化学 来源:2017届江西省九江市十校高三第二次联考理科综合化学试卷(解析版) 题型:实验题
某研究小组选用以下装置(夹持装置省略,装置可重复选用)进行氯化亚铁与氧气反应的探究。已知氯化亚铁的熔点674℃、沸点1023℃;三氯化铁在300℃以上易升华,易溶于水并且有强烈的吸水性。在500℃条件下氯化亚铁与氧气可能发生多种反应,反应之一为:12FeCl2 +3O2 2Fe2O3 +8FeCl3。回答下列问题:
2Fe2O3 +8FeCl3。回答下列问题:
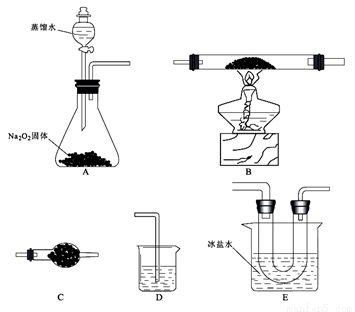
(1)仪器C的名称____________,连接好装置后,加入药品前的操作为___________________。
(2)E装置的作用是______________。
(3)反应过程发现,装置B中除生成红棕色固体外,还观察到黄绿色气体,生成该气体的化学方程式为_____________________________。
(4)待B中充分反应后,停止加热,仍继续通入氧气直至反应管冷却。则停止加热前是否需要先将D中导管口移出水面,为什么?
_____________________________。
(5)设计实验:
①利用E装置U形管里的固体验证Fe(OH)3是弱碱:___________________。(简明扼要写方法)
②利用E装置U形管里的固体,配成溶液,制得某种胶体,写出制备该胶体的化学方程式______________________。
查看答案和解析>>
科目:高中化学 来源:2017届湖南省衡阳市高三实验班第六次月考理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列说法不正确的是( )
A.4.6g金属钠与足量O2充分反应后,所得固体中阴、阳离子的总数为0.3NA
B.1L 0.5 mol/L的FeCl3溶液充分水解后,所得Fe(OH)3胶粒的数目为0.5NA
C.2.0g H218O与D2O的混合物中所含中子数为NA
D.1L含NA个Al3+的Al(NO3)3液中,NO3﹣物质的量浓度大于3 mol/L
查看答案和解析>>
科目:高中化学 来源:河北省2017届高三下学期三调考试理科综合化学试卷 题型:填空题
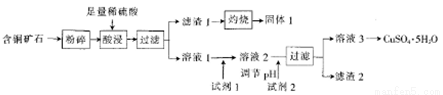
以某含铜矿石[主要成分是FeCuSi3O13(OH)4,含少量SiO2、CaCO3]为原料制备CuSO4·5H2O的流程如下:
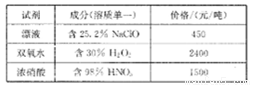
已知相关试剂成分和价格如下表所示:
请回答下列问题:
(1)含铜矿石粉碎的目的是_______。
(2)酸浸后的溶液中除了Cu2+外,还含有的金属阳离子是_______。
(3)固体1溶于NaOH溶液的离子方程式为__________。
(4)结合题中信息可知:所选用的试剂1的名称为_______;加入该试剂时,发生反应的离子方程式为_________。
(5)试剂2 可以选择下列物成中的______。滤渣2中一定含有的物质为______(填化学式)。
A. Cu B.CuO C.Cu(OH)2 D.Fe
(6)CuSO4·5H2O用于电解精炼铜时,导线中通过9.632×103C的电量,测得阳极溶解的铜为16.0g。而电解质溶液(原溶液为1 L)中恰好无CuSO4,则理论上阴极质量增加_____g,原电解液中CuSO4的浓度为__ 。已知一个电子的电量为1.6×10-19C)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com