
��״�ȼ�ϵ����ȣ��Ҵ�ȼ�ϵ�ؾ��ж��Ե͡����������ܶȸߵ��ŵ㣬��˱��㷺��Ϊ�Ǹ���ǰ;��ȼ�ϵ�ء���ͼ��һ���Ҵ�ȼ�ϵ�ع���ʱ��ʾ��ͼ���ҳ��е������缫��Ϊʯī�缫���ҳ���ʢ��100mL3��00mol��L��CuSO4��Һ����ش��������⣺
��1��N�ĵ缫��ӦʽΪ ��
��2���ڴ˹����У��ҳ���ijһ�缫��������ͭ6��4gʱ���׳����������������� L����״���£���
��3���ڴ˹����У����ҳ������缫�������������ǡ�����ʱ����״���£�����������ͨ���Ҵ� g��
��4����ҵ�Ͽ����������з�Ӧ��ȡ�Ҵ���
��ӦI��2CO2��g��+6H2(g)![]() CH3CH2OH��g��+3H2O��g�� 25��ʱ��K=2��95��1011
CH3CH2OH��g��+3H2O��g�� 25��ʱ��K=2��95��1011
��ӦII��2CO2��g��+4H2��g��![]() CH3CH2OH��g��+H2O��g��25��ʱ��K=1.7l��1022
CH3CH2OH��g��+H2O��g��25��ʱ��K=1.7l��1022
��д����ӦI��ƽ�ⳣ������ʽK= ��
��������ͬʱ����ӦI�뷴ӦII��ȣ�ת���̶ȸ������ ��
����һ��ѹǿ�£���÷�ӦI��ʵ���������±���
���ݱ������ݷ�����
�¶����ߣ�Kֵ �����������С�����䡱���������̼�ȡ�n(H2)/n(CO2)���������Ҵ� ���������������������

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| ||
| ||


�¶ȣ�K�� CO2ת���ʣ�%�� n��H2��/n��CO2�� |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��9�֣���״�ȼ�ϵ����ȣ��Ҵ�ȼ�ϵ�ؾ��ж��Ե͡����������ܶȸߵ��ŵ㣬��˱��㷺��Ϊ�Ǹ���ǰ;��ȼ�ϵ�ء���ͼ��һ���Ҵ�ȼ�ϵ�ع���ʱ��ʾ��ͼ���ҳ��е������缫��Ϊʯī�缫���ҳ���ʢ��100 mL3.00 mol/L��CuSO4��Һ����ش��������⣺
(1) �ڳ��³�ѹ�£�1g C2H5OHȼ������CO2��Һ̬H2Oʱ�ų�30kJ��������ʾ�÷�Ӧ���Ȼ�ѧ����ʽΪ ��
(2)N�ĵ缫��ӦʽΪ ��
(3)�ڴ˹����У��ҳ���ijһ�缫��������ͭ6.4gʱ���׳����������������� ��
����״���£�
(4)�ڴ˹����У����ҳ������缫����������ǡ�����ʱ(�����״����)����������ͨ���Ҵ� g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010��2011ѧ���㽭ʡ����ʦ����ѧ������ѧ�߶���ѧ����ĩ���Ի�ѧ�Ծ� ���ͣ������
��9�֣���״�ȼ�ϵ����ȣ��Ҵ�ȼ�ϵ�ؾ��ж��Ե͡����������ܶȸߵ��ŵ㣬��˱��㷺��Ϊ�Ǹ���ǰ;��ȼ�ϵ�ء���ͼ��һ���Ҵ�ȼ�ϵ�ع���ʱ��ʾ��ͼ���ҳ��е������缫��Ϊʯī�缫���ҳ���ʢ��100 mL3.00 mol/L��CuSO4��Һ����ش��������⣺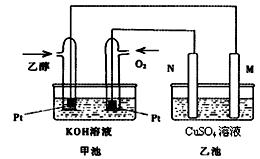
(1) �ڳ��³�ѹ�£�1g C2H5OHȼ������CO2��Һ̬H2Oʱ�ų�30kJ��������ʾ�÷�Ӧ���Ȼ�ѧ����ʽΪ ��
(2)N�ĵ缫��ӦʽΪ ��
(3)�ڴ˹����У��ҳ���ijһ�缫��������ͭ6.4gʱ���׳����������������� ��
����״���£�
(4) �ڴ˹����У����ҳ������缫����������ǡ�����ʱ(�����״�� ��)����������ͨ���Ҵ� g��
��)����������ͨ���Ҵ� g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010-2011ѧ������������и���������ģ�⿼�ԣ����ۣ���ѧ���� ���ͣ������
��״�ȼ�ϵ����ȣ��Ҵ�ȼ�ϵ�ؾ��ж��Ե͡����������ܶȸߵ��ŵ㣬��˱��㷺��Ϊ�Ǹ���ǰ;��ȼ�ϵ�ء���ͼ��һ���Ҵ�ȼ�ϵ�ع���ʱ��ʾ��ͼ���ҳ��е������缫��Ϊʯī�缫���ҳ���ʢ��100mL3��00mol��L��CuSO4��Һ����ش��������⣺

��1��N�ĵ缫��ӦʽΪ ��
��2���ڴ˹����У��ҳ���ijһ�缫��������ͭ6��4gʱ���׳����������������� L����״���£���
��3���ڴ˹����У����ҳ������缫�������������ǡ�����ʱ����״���£�����������ͨ���Ҵ� g��
��4����ҵ�Ͽ����������з�Ӧ��ȡ�Ҵ���
��ӦI��2CO2��g��+6H2(g)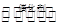 CH3CH2OH��g��+3H2O��g�� 25��ʱ��K=2��95��1011
CH3CH2OH��g��+3H2O��g�� 25��ʱ��K=2��95��1011
��ӦII��2CO2��g��+4H2��g��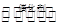 CH3CH2OH��g��+H2O��g��25��ʱ��K=1.7l��1022
CH3CH2OH��g��+H2O��g��25��ʱ��K=1.7l��1022
��д����ӦI��ƽ�ⳣ������ʽK= ��
��������ͬʱ����ӦI�뷴ӦII��ȣ�ת���̶ȸ������ ��
����һ��ѹǿ�£���÷�ӦI��ʵ���������±���
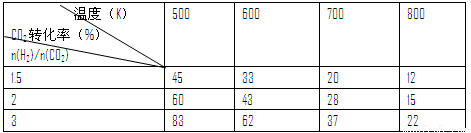
���ݱ������ݷ�����
�¶����ߣ�Kֵ �����������С�����䡱���������̼�ȡ�n(H2)/n(CO2)���������Ҵ� ���������������������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com