
 有关M的下列叙述中正确的是( )
有关M的下列叙述中正确的是( )| A. | 分子式为C10H11O3Cl | |
| B. | 一定条件下可以发生取代反应、加成反应、氧化反应 | |
| C. | 可与NaOH溶液反应,1mol M最多消耗4mol NaOH | |
| D. | 既能与FeCl3发生显色反应,也能和 Na2CO3溶液反应放出CO2. |
分析 A.根据结构简式确定分子式;
B.该物质中含有酚羟基、酯基、氯原子、碳碳双键,所以具有酚、酯、卤代烃、烯烃性质;
C.酚羟基、酯基水解生成的酚羟基和羧基及氯原子水解生成的HCl都能和NaOH反应;
D.酚能和氯化铁溶液发生显色反应,酚羟基能和碳酸钠反应但不能生成二氧化碳.
解答 解:A.根据结构简式知其分子式为C10H9O3Cl,故A错误;
B.该物质中含有酚羟基、酯基、氯原子、碳碳双键,所以具有酚、酯、卤代烃、烯烃性质,酚羟基、酯基、氯原子能发生取代反应,苯环和碳碳双键能发生加成反应,酚羟基、碳碳双键能发生氧化反应,故B正确;
C.酚羟基、酯基水解生成的酚羟基和羧基及氯原子水解生成的HCl都能和NaOH反应,所以可与NaOH溶液反应,1mol M最多消耗4mol NaOH,故C正确;
D.酚能和氯化铁溶液发生显色反应,酚羟基能和碳酸钠反应但不能生成二氧化碳,生成-ONa和碳酸氢钠,故D错误;
故选BC.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查酚、酯、烯烃、卤代烃性质,易错选项是C,注意卤代烃水解生成的HX能和氢氧化钠反应,为易错点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入稀H2SO4,过滤 | B. | 加入NaCl溶液,过滤 | ||
| C. | 加入NaOH溶液,过滤 | D. | 加入CuSO4溶液,过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 有 关 信 息 |
| A | 元素主要化合价为-2,原子半径为0.074nm |
| B | 所在主族序数与所在周期序数之差为4 |
| C | 原子半径为0.102nm,其单质为黄色晶体,可在A的单质中燃烧 |
| D | 最高价氧化物的水化物能按1:1电离出电子数相等的阴、阳离子 |
| E | 原子半径为0.075nm,最高价氧化物的水化物可与其氢化物形成一种盐X |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ②④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠的水解方程式:HCO3-+H2O=CO32-+H3O+ | |
| B. | 在稀溶液中,酸跟碱反应生成1mol水时放出57.3KJ的热量,则稀盐酸与澄清石灰水发生中和反应的热化学方程式为H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1 | |
| C. | 向NaHSO4溶液中加入过量Ba(OH)2溶液的离子方程式:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| D. | 用Na2CO3溶液吸收少量SO2的离子方程式:CO32-+SO2═CO2+SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
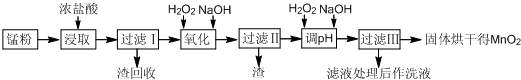
| 开始沉淀 | 沉淀完全 | |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 )
)| A. | ②④⑤⑦ | B. | ①④⑥⑧ | C. | ②③⑤⑧ | D. | ①③⑥⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 钠与水的反应:2Na+2H2O═2Na++OH-+H2↑ | |
| C. | 碳酸钙溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 氯化亚铁溶液中通入氯气:2Fe2++Cl2═2Fe3++2Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com