
【题目】“锌+碘”新型安全动力电池有望取代目前广泛使用的“铅蓄电池”、“锂电池”等,已知该电池的工作原理如图所示。下列有关说法错误的是

A. 该电池安全性高,且对环境友好
B. 正极反应式为I3-+2e-=3I-,电极a附近显红色
C. 电子的移动方向为“Zn→电极a→电极b→石墨毡”
D. “回流通道”可以减缓电池两室的压差,避免电池受损
科目:高中化学 来源: 题型:
【题目】.检测人的血液中的葡萄糖(简称血糖,相对分子质量为180)的含量,参考指标常以两种计量单位表示,即“m mol/L”和“mg/dL”(1L=10dL).以“m mol/L”表示时,人的血糖正常值在3.61~6.11m mol/L之间。如果以“mg/dL”表示,血糖正常值范围是多少()
A. 6 mg/dL ~9mg/dL B. 55 mg/dL ~95mg/dL
C. 65 mg/dL ~110mg/dL D. 70 mg/dL ~120mg/dL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是元素周期表中的短周期元素,它们的相对位置如表所示,其中X、Y 元素均能形成10电子的氢化物,Z的原子序数是Y的2倍。请回答下列问题:
X | Y | |
Z | W |
(1)W的简单离子的结构示意图为___________,Y的氢化物电子式为___________。
(2)Z、W元素的最高价氧化物对应水化物的酸性强的是___________(填化学式,下同),X、Y 元素的10电子的氢化物中稳定性较弱的是_________。
(3)写出单质碳与X元素最高价氧化物的水化物浓溶液共热的化学方程式__________。
(4)W与Z形成的液体化合物Z2W2,该物质可与水反应生成一种能使品红溶液褪色的气体,
1 mol Z2W2参加反应时转移1.5 mol电子,其中只有一种元素化合价发生改变,Z2W2与水反应的化学方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中,对下列事故处理正确的是( )
A.汽油失火时,立即用水灭火
B.热液体的试管口不能正对着自己或别人
C.少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液擦洗
D.实验室中使用酒精灯时应用外焰加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年11月在法国凡尔赛召开了国际计量大会,会议将阿伏加德罗常数的定义修改为“1摩尔包含6.02214076×1023个基本单元,这一常数被称为阿伏加德罗常数,单位为mol-1”。若NA表示阿伏加德罗常数的值,则下列说法错误的是
A. 新定义中阿伏加德罗常数的不确定度被消除
B. 常温常压下,11.2LO2与N2组成的混合气体,含有原子个数小于NA
C. 117号元素符号为Ts(中文名![]() ),其重氢化物D293Ts含有中子数为177NA
),其重氢化物D293Ts含有中子数为177NA
D. 60.0gC3H8O中含有的C-C键可能小于2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知断裂1molH-H要吸收的能量为436kJ,形成1molH-N放出391kJ的能量,氨气的结构如图,根据化学方程式N2+3H2 ![]() 2NH3,1molN2与3molH2反应时放热92kJ,则断裂1molN≡N所需要的能量为 ( )
2NH3,1molN2与3molH2反应时放热92kJ,则断裂1molN≡N所需要的能量为 ( )
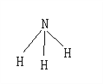
A. 431kJ B. 698kJ C. 946kJ D. 394kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以用来断定碳酸氢钠粉末中是否混有碳酸钠的实验方法是( )
A.加热时有无色气体放出
B.滴加盐酸时有无气泡放出
C.溶于水后,滴加澄清的石灰水,有无白色沉淀生成
D.溶于水后,滴加稀的BaCl2溶液,有无白色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
锆英石常用于耐火材料,其矿砂常与钛铁矿、金红石、石英共生。针对相关物质,回答下列问题:
(1)下列基态Si原子结构的表示方法中最能准确表示出电子排布特点的是___________(填标号,下同),能够表示出原子核构成特点的是___________。

(2)SiO2晶体常伴生于各种矿石中,其晶体结构中,最小的环上有___________个原子;Si与C元素位于同一主族,比较SiO2与CO2的键角大小:SiO2___________CO2(填写“大于”、“小于”或“等于”),原因是________________。
(3)钛铁矿经过H2SO4、HNO3等多种物质处理后会生成TiOSO2等中间产物。
①TiOSO4晶体中存在_______(填标号)。
A.离子键 B.σ键 C.π键 D.氢键
②H2SO4为粘稠状、难挥发性的强酸,而HNO3是易挥发性的强酸,其原因是___________。
(4)FeO是离子晶体,其晶格能可通过下图的Born- Haber循环计算得到。

可知,O原子的第一电子亲和能为________kJ·mo-1,FeO晶格能为________ kJ·mo-1。
(5)ZrO2可用于制造高温发热元件,其在高温时具有立方晶型,晶胞如图所示。已知晶胞参数为anm,阿伏加德罗常数的值为NA,则Zr原子与O原子之间的最短距离为___________nm;ZrO2的密度为___________g·cm-3(列式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使反应4NH3(g)+3O2(g)=2N2(g)+6H2O(g)在2L的密闭容器中进行,半分钟后N2的物质的量增加了0.6mol。此反应的平均速率v(X)为
A. v(NH3)=0.02mol·L-1·s-1
B. v(O2)=0.01mol·L-1·s-1
C. v(N2)=0.02mol·L-1·s-1
D. v(H2O)=0.02mol·L-1·s-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com