
| A. | Ba2+、K+、SO42- | B. | Ca2+、NO3-、Cl- | C. | Na+、Mg2+、OH- | D. | H+、Cl-、HCO3- |
科目:高中化学 来源: 题型:选择题
| A. | 侯德榜--创立了联合制碱法 | |
| B. | 凯库勒--首次提出了“有机化学”概念 | |
| C. | C维勒--首次用无机物合成了有机物 | |
| D. | 门捷列夫--创设了元素周期表 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 | 编号 | 实验温度/℃ | 药品 | |
| Ⅰ | ① | 25 | 铝条 | 盐酸5ml3mol•L-1 |
| ② | 25 | 铝条(规格同上) | 盐酸5ml0.5mol•L-1 | |
| Ⅱ | ① | 25 | 碳酸钙粉末 | 盐酸5ml3mol•L-1 |
| ② | 25 | 块状碳酸钙 | 盐酸5ml3mol•L-1 | |
| Ⅲ | ① | 5 | 二氧化氮与四氧化二氮的混合气体 | |
| ② | 35 | 二氧化氮与四氧化二氮的混合气体 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

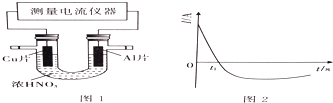 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 目 的 | 试剂及方法 |
| 鉴别丝绸和棉布 | |
| 除去CO中混有少量CO2 | |
| 证明Na2CO3溶液呈碱性 | |
| 检验溶液中是否含Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 共价化合物中一定不含离子键 | |
| B. | 离子化合物中一定不含共价键 | |
| C. | 任何化学物质中均存在化学键 | |
| D. | 全部由非金属元素形成的化合物一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同时增大 | B. | v1减小,v2增大 | C. | 同时减小 | D. | v1增大,v2减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com