
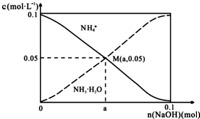
 常温下,向1L0.1mol•L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3•H2O的变化趋势如图所示(不考虑体积变化和氨的挥发),下列说法正确的是( )
常温下,向1L0.1mol•L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3•H2O的变化趋势如图所示(不考虑体积变化和氨的挥发),下列说法正确的是( )| A. | M点溶液中水的电离程度比原溶液大 | |
| B. | 在M点时,n(OH-)-n(H+)=(a-0.05)mol | |
| C. | 随着NaOH的加入,$\frac{c({H}^{+})}{c(N{H}_{4}^{+})}$不断增大 | |
| D. | 当n(NaOH)=0.05mol时溶液中有:c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+) |
分析 A.M点是向1L 0.1mol•L-1NH4Cl溶液中,不断加入NaOH固体后反应得到氯化铵和一水合氨溶液,铵根离子浓度和一水合氨浓度相同,一水合氨是一元弱碱抑制水电离;
B.依据溶液中电荷守恒分析判断,n(Na+)=amol,n(Cl-)=1mol;
C.铵根离子水解显酸性,结合水解平衡常数分析,$\frac{c({H}^{+})}{c(N{{H}_{4}}^{+})}$×$\frac{c(N{H}_{3}•{H}_{2}O)}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{{K}_{h}}{c(N{H}_{3}•{H}_{2}O)}$;
D.向1L 0.1mol•L-1NH4Cl溶液中,不断加入NaOH固体后,当n(NaOH)=0.05mol时,得到物质的量均为0.05molNH4Cl、0.05molNaCl和0.05molNH3•H2O的混合物.
解答 解:A.M点是向1L 0.1mol•L-1NH4Cl溶液中,不断加入NaOH固体后反应得到氯化铵和一水合氨溶液,铵根离子浓度和一水合氨浓度相同,一水合氨是一元弱碱抑制水电离,此时水的电离程度小于原氯化铵溶液中水的电离程度,故A错误;
B.在M点时溶液中存在电荷守恒,n(0H-)+n(Cl-)=n(H+)+n(Na+)+n(NH4+),n(0H-)-n(H+)=0.05+n(Na+)-n(Cl-)=(a-0.05)mol,故B正确;
C.铵根离子水解显酸性,结合水解平衡常数分析$\frac{c({H}^{+})}{c(N{{H}_{4}}^{+})}$×$\frac{c(N{H}_{3}•{H}_{2}O)}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{{K}_{h}}{c(N{H}_{3}•{H}_{2}O)}$,随氢氧化钠固体加入,反应生成一水合氨浓度增大,平衡常数不变,则$\frac{c({H}^{+})}{c(N{{H}_{4}}^{+})}$减小,故C错误;
D.向1L 0.1mol•L-1NH4Cl溶液中,不断加入NaOH固体后,当n(NaOH)=0.05mol时,得到物质的量均为0.05molNH4Cl、0.05molNaCl和0.05molNH3•H2O的混合物,由于NH3•H2O电离大于NH4Cl水解,故离子浓度大小关系为:c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+),故D错误.
故选B.
点评 本题考查了酸碱反应过程分析,主要是溶液酸碱性、离子浓度大小,对水的电离影响因素分析判断,题目难度中等.


 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:解答题
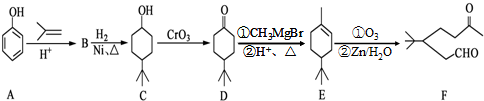
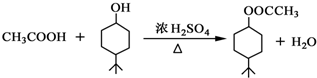 .
.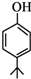 .同时满足下列条件的B的同分异构体(不包括B)共有11种:
.同时满足下列条件的B的同分异构体(不包括B)共有11种: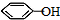 )和烃W为主要原料制备有机物3-乙基-1,6-已二酸的合成路线
)和烃W为主要原料制备有机物3-乙基-1,6-已二酸的合成路线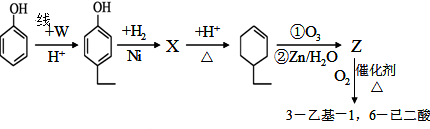
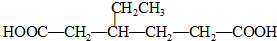
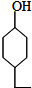 ,Z:
,Z: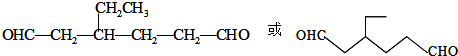 ;
;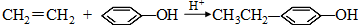 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 倭铅是指金属锌和铅的混合物 | |
| B. | 煤炭中起作用的主要成分是C | |
| C. | 冶炼Zn的反应方程式为:ZnCO3+2C$\frac{\underline{\;高温\;}}{\;}$Zn+3CO↑ | |
| D. | 该冶炼锌的方法属于热还原法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3俗称铁红,常用作红色油漆和涂料 | |
| B. | 二氧化硫具有漂白性,可用来增白纸浆、草帽辫、食品等,还可用于杀菌消毒 | |
| C. | 废旧钢材焊接前,分别用饱和Na2CO3,NH4Cl溶液处理焊点 | |
| D. | 聚丙烯酸钠树脂广泛应用于植物移栽及制作尿不湿 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 羊毛、棉花、淀粉都是自然界存在的天然高分子化合物 | |
| B. | 生物炼铜的原理是利用某些具有特殊本领的细菌把不溶性的硫化铜转化为铜单质 | |
| C. | 霾是悬浮在大气中的大量微小尘粒、烟粒或盐粒的集合体,霾的形成与PM2.5有直接关系 | |
| D. | 一些有机溶剂(如乙醚、乙醇、苯、丙酮等)沸点低且极易被引燃,加热时最好用水浴加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,用离子方程式表示NaCN溶液呈碱性的原因CN-+H2O?HCN+OH-
,用离子方程式表示NaCN溶液呈碱性的原因CN-+H2O?HCN+OH-| 实验 序号 | 电极 (X) | NaCI溶液浓度 (mol/L) | 甲中石墨表面通人气体 | 电流计读数 (A) |
| (1) | Fe | O.l | 空气 | I |
| (2) | Al | 0.1 | 空气 | 1.5Ⅰ |
| (3) | Fe | 0.1 | 02 | 2Ⅰ |
| (4) | Al | 0.5 | 空气 | 1.6Ⅰ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
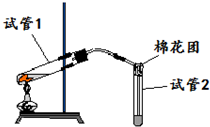 如图是实验室用铜片与浓硫酸反应制取SO2,并验证其性质的装置图.往试管1中加入一小块铜片,再加入3~5mL浓硫酸,用带导管的单孔橡胶塞塞好试管,加热,将生成的气体通入试管2的溶液中.回答以下问题:
如图是实验室用铜片与浓硫酸反应制取SO2,并验证其性质的装置图.往试管1中加入一小块铜片,再加入3~5mL浓硫酸,用带导管的单孔橡胶塞塞好试管,加热,将生成的气体通入试管2的溶液中.回答以下问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com