
科目:高中化学 来源:不详 题型:单选题
| A.雪是由水蒸气凝华而成的,该过程有能量放出 |
| B.雪融化为水后能量增加 |
| C.雪融化为水时要吸收能量,导致环境温度升高 |
| D.在雪上撒大量的以NaCl、MgCl2等为主要成分的融雪剂,虽能使雪融化但易造成环境污染 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na与水反应时增大水的用量 |
| B.Fe与稀硫酸反应制取氢气时,改用浓硫酸 |
| C.在K2SO4与BaCl2两溶液反应时,增大压强 |
| D.将铝片改为铝粉,做铝与氧气反应的实验 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①④ | B.②③⑤ | C.①③ | D.①②④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.食品放在冰箱中贮藏 |
| B.双氧水制氧气时加入少量二氧化锰 |
| C.试管中进行镁和水反应时,稍微加热 |
| D.铁粉代替铁钉与稀硫酸反应制取氢气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 实验测得不同温度下的平衡数据列于下表:
实验测得不同温度下的平衡数据列于下表:
| A.2v(NH3)=v(C02) | B.密闭容器中总压强不变 |
| C.密闭容器中混合气体的密度不变 | D.密闭容器中氨气的体积分数不变 |
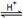
 该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到C(NH2C00-)随时间的变化趋势如图所示。
该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到C(NH2C00-)随时间的变化趋势如图所示。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Y(g)+Z(g) △H<0,反应到8min时达到平衡;在14min时改变体系的温度, 16min时建立新平衡。X的物质的量浓度变化如图所示。下列有关说法正确的是
Y(g)+Z(g) △H<0,反应到8min时达到平衡;在14min时改变体系的温度, 16min时建立新平衡。X的物质的量浓度变化如图所示。下列有关说法正确的是
| A.0~8min用Y表示该反应速率为0.1mol·L-1·min-1 |
| B.8min时达到平衡,该反应的平衡常数为K= 0.5 |
| C.14min时,改变的反应条是降低了温度 |
| D.16min时的正反应速率比8min时的正反应速率大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| 物质 | HCOOH | CH3OH | HCOOCH3 |
| 主要 性质 | 无色液体,与水互溶 K(HCOOH)>K(CH3COOH) | 无色液体,与水互溶 | 无色液体,在水中溶解度小,与醇互溶 |
 HCOOH(l) + CH3OH(l),反应吸热,但焓变的值很小。常温常压下,水解反应速率和平衡常数都较小。
HCOOH(l) + CH3OH(l),反应吸热,但焓变的值很小。常温常压下,水解反应速率和平衡常数都较小。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.图①表示一定条件下某化学反应的速率随时间变化的趋势图,该反应一定为放热反应 |
| B.图②中曲线表示将氢氧化钠溶液滴加到醋酸溶液浓度的变化趋势图 |
| C.图③表示等体积、等物质的量浓度的盐酸和醋酸,分别加足量镁粉,产生H2的物质的量的变化 |
| D.图④为水的电离平衡曲线图,若从A点到C点,可采用在水中加入适量NaOH固体的方法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com