
【题目】优化反应条件是研究化学反应的重要方向。
(1)以硫代硫酸钠与硫酸的反应Na2S2O3 + H2SO4= Na2SO4 + SO2+ S↓ + H2O为例,探究外界条件对化学反应速率的影响,实验方案如下表所示。
实验 序号 | Na2S2O3溶液 | H2SO4溶液 | 蒸馏水 | 温度/℃ | ||
浓度/(mol/L) | 体积/mL | 浓度/(mol/L) | 体积/mL | 体积/mL | ||
I | 0.1 | 1.5 | 0.1 | 1.5 | 10 | 20 |
II | 0.1 | 2.5 | 0.1 | 1.5 | 9 | a |
III | 0.1 | b | 0.1 | 1.5 | 9 | 30 |
①表中,a为________________________,b为________________。
②实验表明,实验III的反应速率最快,支持这一结论的实验现象为_________________________。
(2)硫代硫酸钠可用于从含氧化银的矿渣中浸出银,反应如下:Ag2O + 4S2O32- + H2O ![]() 2[Ag(S2O3)2]3- + 2OH-,实际生产中,为了提高银的浸出率需要调节pH的范围为8.5~9.5,解释其原因________
2[Ag(S2O3)2]3- + 2OH-,实际生产中,为了提高银的浸出率需要调节pH的范围为8.5~9.5,解释其原因________
(3)工业上常用空气催化氧化法除去电石渣浆(含CaO)上清液中的S2-,并制取石膏(CaSO4·2H2O),其中的物质转化过程如下图所示。
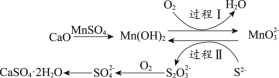
①过程I、II中,起催化剂作用的物质是_______________。
②过程II中,反应的离子方程式为_________。
③根据物质转化过程,若将10 L上清液中的S2-转化为SO42-(S2-浓度为320 mg/L),理论上共需要标准状况下的O2的体积为___________L。
【答案】20 2.5 实验III中出现浑浊所需时间最短 若pH小于8.5,c(H+)增大,H+与S2O32-反应使c(S2O32-)减小,不利于反应正向进行,浸出率下降;若pH大于9.5,c(OH-)增大,不利于反应正向进行,浸出率下降 Mn(OH)2 4MnO32- +2S2- + 9H2O = S2O32- + 4Mn(OH)2↓ + 10OH- 4.48
【解析】
(1)①探究反应速率的影响遵循控制变量的思想,实验I和实验II中溶液的体积不同,则温度应相同,则a为20,实验II和实验III,温度不同,则其他变量应相同,则b为2.5,
答案为:20;2.5;
②根据反应Na2S2O3 + H2SO4= Na2SO4 + SO2+ S↓ + H2O可知,通过实验现象能表现出反应快慢的现象是产生硫沉淀的速度,硫沉淀出现越快表明反应速率越快,能表明实验III的反应速率最快的实验现象为出现浑浊所需时间最短,
答案为:实验III中出现浑浊所需时间最短;
(2)根据Ag2O + 4S2O32- + H2O ![]() 2[Ag(S2O3)2]3- + 2OH-为可逆反应,若pH小于8.5,c(H+)增大,H+与S2O32-反应使c(S2O32-)减小,不利于反应正向进行,浸出率下降;若pH大于9.5,c(OH-)增大,不利于反应正向进行,浸出率下降,
2[Ag(S2O3)2]3- + 2OH-为可逆反应,若pH小于8.5,c(H+)增大,H+与S2O32-反应使c(S2O32-)减小,不利于反应正向进行,浸出率下降;若pH大于9.5,c(OH-)增大,不利于反应正向进行,浸出率下降,
答案为:若pH小于8.5,c(H+)增大,H+与S2O32-反应使c(S2O32-)减小,不利于反应正向进行,浸出率下降;若pH大于9.5,c(OH-)增大,不利于反应正向进行,浸出率下降;
(3)①根据过程I、II中的转化关系,起催化剂作用的物质是Mn(OH)2,
答案为:Mn(OH)2;
②根据转化关系图,过程II中S2-与MnO32-生成S2O32-和Mn(OH)2,根据氧化还原反应得失电子守恒和物料守恒,反应的离子方程式为4MnO32- +2S2- + 9H2O = S2O32- + 4Mn(OH)2↓ + 10OH-,
③10 L上清液中的S2-的物质的量= =0.1mol,根据物质转化过程,S2-转化为S2O32-过程中需要消耗氧气,S2O32-转化为SO42-也需要消耗氧气,0.1mol S2-转化为S2O32-时,硫元素的化合价由-2价变为+2,共失去0.1mol×4=0.4mol电子;氧气转变为水时氧元素由0价变为-2价,即1mol氧气转移4mol电子,根据电子得失守恒,得到0.4mol电子需要氧气的物质的量=
=0.1mol,根据物质转化过程,S2-转化为S2O32-过程中需要消耗氧气,S2O32-转化为SO42-也需要消耗氧气,0.1mol S2-转化为S2O32-时,硫元素的化合价由-2价变为+2,共失去0.1mol×4=0.4mol电子;氧气转变为水时氧元素由0价变为-2价,即1mol氧气转移4mol电子,根据电子得失守恒,得到0.4mol电子需要氧气的物质的量=![]() =0.1mol;根据反应4MnO32- +2S2- + 9H2O = S2O32- + 4Mn(OH)2↓ + 10OH-,0.1mol S2-参与反应生成S2O32-的物质的量=
=0.1mol;根据反应4MnO32- +2S2- + 9H2O = S2O32- + 4Mn(OH)2↓ + 10OH-,0.1mol S2-参与反应生成S2O32-的物质的量=![]() ×0.1mol=0.05mol,0.05mol S2O32-转化为SO42-,硫元素的化合价由+2价变为+6价,共失去0.05mol×2×4=0.4mol电子,氧气由0价变为-2价,即1mol氧气转移4mol电子,根据电子得失守恒,得到0.4mol电子需要氧气的物质的量=
×0.1mol=0.05mol,0.05mol S2O32-转化为SO42-,硫元素的化合价由+2价变为+6价,共失去0.05mol×2×4=0.4mol电子,氧气由0价变为-2价,即1mol氧气转移4mol电子,根据电子得失守恒,得到0.4mol电子需要氧气的物质的量=![]() =0.1mol;则上清液中的S2-转化为SO42-过程中一共需要氧气的物质的量=0.1mol+0.1mol=0.2mol,标准状况下的O2的体积=0.2mol×22.4L/mol=4.48L,
=0.1mol;则上清液中的S2-转化为SO42-过程中一共需要氧气的物质的量=0.1mol+0.1mol=0.2mol,标准状况下的O2的体积=0.2mol×22.4L/mol=4.48L,
答案为:4.48。


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 等体积等物质的量浓度的CH3COONa(aq)与NaCl(aq)中离子总数大小:N前=N后
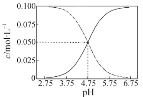
B. 常温下醋酸和醋酸钠混合溶液中c (CH3COOH)、c (CH3COO-)与pH值的关系如图所示,当pH=4.5溶液中:c (CH3COO-)> c (CH3COOH)> c (H+)> c (OH-)
C. 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合后的溶液中:2 c(Na+)=c(CH3COO-)+ c(CH3COOH)
D. pH相等的盐酸与醋酸溶液,c(Cl-)>c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】550℃时,有如下反应:2SO2+O2![]() 2SO3 ΔH<0。把2molSO2和1molO2放入恒容的密闭容器中,判断该反应达到平衡状态的标志是( )
2SO3 ΔH<0。把2molSO2和1molO2放入恒容的密闭容器中,判断该反应达到平衡状态的标志是( )
A. SO2和SO3浓度相等
B. 单位时间内反应掉0.2molSO2的同时生成了0.2molSO3
C. 容器中气体的压强不变
D. 容器中混合气体的密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C三只烧杯中,依次分别盛有NaOH溶液、KSCN溶液、煮沸的蒸馏水,各滴入FeCl3溶液,试根据实验现象分别回答以下问题:
(1)分别写出三只烧杯中形成分散系的名称:
A________,B________,C________。
(2)写出C中形成分散系的化学方程式:_____________________________________。
(3)若不用化学试剂鉴别,写出鉴别B、C分散系的两种简单方法:
①______________________________________________________,
②________________________________________________________。
(4)向C中逐滴加入稀H2SO4,现象为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数为NA,则下列说法正确的是( )
A.36.5gHCl中H+数目为NA
B.标准状况下,22.4L氨水中含有NA个NH3分子
C.常温常压下,1.6gO2和O3的混合气体中含有氧原子数为0.1 NA
D.0.1 mol·L—1NaCl溶液中阴离子总数为0.1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素化合价与原子序数的关系图,下列说法不正确的是

A. 离子半径: X>Y>Z
B. WX3和水反应形成的化合物是离子化合物
C. 最高价氧化物对应的水化物酸性:R>W
D. Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据信息填空:
(1)FeCl3溶液常用于腐蚀印刷电路铜板,发生反应2FeCl3 +Cu ===2FeCl2 +CuCl2,若将此反应设计成原电池,则负极所用的电极材料为____;当线路中转移0.2mol电子时,则被腐蚀的铜的质量为____。
(2)如图所示,把试管放入盛有25℃的饱和澄清石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5 mL盐酸于试管中,可观察到溶液变浑浊,试回答下列问题:
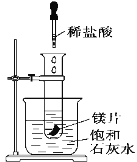
①产生上述现象的原因是___________________________;
②写出有关反应的离子方程式___________________。
③由实验推知,MgCl2和H2的总能量__________(填“大于”、“小于”或“等于”)Mg和HCl的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
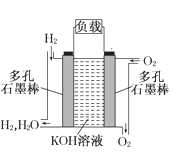
【题目】氢气被看做是理想的“绿色能源”。用高压氢气、氧气制作氢氧燃料电池是利用氢能的一种重要方式(装置如图所示)。请写出氢氧燃料电池(电解质溶液为KOH溶液)的电极反应式。正极_____________;负极_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com