
【题目】某实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
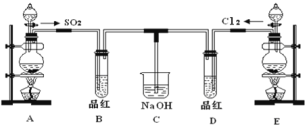
(1)实验室用装置E制备Cl2,其反应的离子方程式为__________________________;若有8mol的HCl参加反应,则转移的电子总数为________。
(2)该装置中氢氧化钠溶液的作用是___________________。
(3)通气后B、D两个试管中的现象______________。停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B:________,D:________。
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用离子方程式表示)____________________。
【答案】MnO2+4H++2Cl-![]() Mn2++2H2O+Cl2↑ 4NA或2.408×1024 尾气处理,吸收过量的SO2和 Cl2 ,以防止污染环境 品红褪色 溶液变为红色 溶液无变化 SO2+Cl2+2H2O=4H++2Cl-+SO42-
Mn2++2H2O+Cl2↑ 4NA或2.408×1024 尾气处理,吸收过量的SO2和 Cl2 ,以防止污染环境 品红褪色 溶液变为红色 溶液无变化 SO2+Cl2+2H2O=4H++2Cl-+SO42-
【解析】
根据实验装置分析实验中涉及的化学反应;根据二氧化硫和氯气的化学性质分析解答问题。
A装置制备二氧化硫气体,B装置检验SO2气体,二氧化硫能使品红溶液褪色,E装置是将二氧化锰和浓盐酸共热的条件下反应生成氯气。
(1)实验室制备氯气可使用二氧化锰和浓盐酸共热的条件下反应生成氯气、氯化锰和水,方程式为:MnO2+4HCl![]() MnCl2+2H2O+Cl2↑,离子方程式为:MnO2+4H++2Cl-
MnCl2+2H2O+Cl2↑,离子方程式为:MnO2+4H++2Cl-![]() Mn2++2H2O+Cl2↑,其中盐酸中的Cl元素只有一半化合价升高,即4molHCl中只有2molHCl表现还原性,那么若有8mol的HCl参加反应,则只有4molHCl参与氧化还原反应,转移4mol电子,转移的电子总数为4NA;
Mn2++2H2O+Cl2↑,其中盐酸中的Cl元素只有一半化合价升高,即4molHCl中只有2molHCl表现还原性,那么若有8mol的HCl参加反应,则只有4molHCl参与氧化还原反应,转移4mol电子,转移的电子总数为4NA;
故答案为:MnO2+4H++2Cl-![]() Mn2++2H2O+Cl2↑,4NA或2.408×1024;
Mn2++2H2O+Cl2↑,4NA或2.408×1024;
(2)氯气和二氧化硫都有毒,所以根据图示分析,氢氧化钠的作用为尾气处理,吸收过量的SO2和 Cl2 ,以防止污染环境,
故答案为:尾气处理,吸收过量的SO2和 Cl2 ,以防止污染环境;
(3) 二氧化硫和氯气都可以使品红褪色,故通气后B、D两个试管中的现象是品红褪色;二氧化硫的漂白是因为二氧化硫和有色物质反应生成不稳定的无色物质,所以加热时,又会恢复颜色,而氯气的漂白是次氯酸的强氧化性,加热时颜色不会改变,
故答案为:品红褪色;溶液变为红色;溶液无变化;
(4)二氧化硫有还原性,氯气有氧化性,它们1:1混合会恰好完全反应生成硫酸和盐酸,而硫酸和盐酸没有漂白性,离子方程式为:SO2+Cl2+2H2O=4H++2Cl-+SO42-;
故答案为:SO2+Cl2+2H2O=4H++2Cl-+SO42-。


科目:高中化学 来源: 题型:
【题目】对于有机物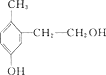 下列说法中正确的是:
下列说法中正确的是:
A. 它是苯酚的同系物
B. 1 mol该有机物能与溴水反应,发生取代反应,消耗2 mol Br2
C. 1 mol该有机物能与金属钠反应产生0.5molH2
D. 1mol该机物能与1molNaHCO3反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有一真空瓶质量为m1,该瓶充入空气后质量为m2。在相同状况下,若改为充入某气体A时,总质量为m3。已知空气相对分子质量为29,则A的相对分子质量是_______________
(2)把一定量铁粉放入氯化铁溶液中,完全反应后,得到溶液中Fe2+和Fe3+的浓度恰好相等。则已反应的Fe3+和未反应的Fe3+的物质的量之比为___________
(3)已知铜和稀硝酸反应方程式为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,则被氧化的物质与被还原的物质质量比为___________
(4)A、B两个烧瓶中分别装80mL 3.0 mol/L的盐酸和NaOH溶液,再分别加等质量的铝粉,在相同状况下产生的气体的体积比为A:B=2:5,则加入铝粉的质量为___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2分解速率受多种因素影响。实验测得70℃时不同条件下H2O2浓度随时间的变化如下图所示。下列说法正确的是
A.  图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B.  图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
C.  图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快
图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快
D. 
 图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分类的正确组合是( )
碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
A | Cu2(OH)2CO3 | H2SO4 | NaHCO3 | SiO2 | CO2 |
B | NaOH | HCl | NaCl | Na2O | CO |
C | NaOH | NH3 | CaCl2 | MgO | SO2 |
D | KOH | HNO3 | CaCO3 | CaO | SO2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,满足表中图示物质在一定条件下能一步转化的组合有
序号 | X | Y | Z | W |
|
① | Cu | CuSO4 | Cu(OH)2 | CuO | |
② | Na | NaOH | Na2CO3 | NaCl | |
③ | Al | AlCl3 | Al(OH)3 | Al2O3 | |
④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
A. ②③ B. ①③④ C. ①④ D. ①②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com