
使2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g) 2NH3(g)(正反应为放热反应)。下列说法错误的是
2NH3(g)(正反应为放热反应)。下列说法错误的是
A.升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量变大
B.升高平衡体系的温度(保持体积不变),混合气体的密度不变
C.当反应达到平衡时,N2和H2的浓度比是1∶3
D.当达到平衡时,充入氩气,并保持压强不变,平衡将逆向移动
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)1.1中和反应反应热的测定(解析版) 题型:选择题
中和热测定实验中,下列操作一定会降低实验准确性的是( )
A.用滴定管取所用药品
B.NaOH溶液在倒入小烧杯时,有少量溅出
C.大、小烧杯体积相差较大,夹层间放的碎泡沫塑料较多
D.测量HCl溶液的温度计用水洗净后才用来测NaOH溶液的温度
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学铁及其化合物主要性质(解析版) 题型:填空题
铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题:
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸的溶液中含有的大量阳离子是 。(2)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等四种离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并将灼烧后的固体投入过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是 。A.Mg2+ B.Fe2+
C.Al3+ D.Cu2+
(3)氧化铁是重要工业颜料,用废铁屑制备它的流程如下:
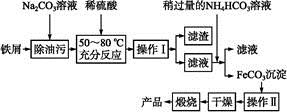
回答下列问题:
①操作Ⅰ的名称是 ,操作Ⅱ的名称是 。②写出在空气中煅烧FeCO3的化学方程式 。(4)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定。
a.称取2.850 g绿矾(FeSO4·7H2O)产品,溶解,在250 mL容量瓶中定容;
b.量取25.00 mL待测溶液放入锥形瓶中;
c.用硫酸酸化的0.010 00 mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00 mL。
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需 。②某同学设计的下列滴定方式,最合理的是 。(夹持部分略去)(填字母序号)
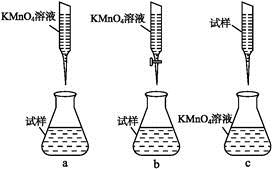
③写出滴定过程中反应的离子方程式 。④计算上述样品中FeSO4·7H2O的质量分数为 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学钠及其化合物主要性质(解析版) 题型:选择题
有A、B、C、D、E和F六瓶无色溶液,它们都是中学化学中常用的无机试剂。E的溶质是一种无色油状液体;B、C、D和F是盐溶液,且它们的阴离子均不同。现进行如下实验:
①A有刺激性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾;②将A分别加入其他五种溶液中,只有D、F中有沉淀产生,继续加入过量A时,D中沉淀无变化,F中沉淀完全溶解;③将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色、无味气体逸出;④将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3,沉淀均不溶。根据上述实验信息,下列说法错误的是
A.B可能是NaHCO3溶液
B.F为AgNO3溶液
C.D不可能是镁或铝的盐酸盐
D.A为氨水,E为硫酸
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学速率表示与平衡移动(解析版) 题型:选择题
已知反应4NH3+5O2 4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列正确的关系是
4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列正确的关系是
A.v(NH3)=v(O2) B.v(O2)=v(H2O)
C.v(NH3)=v(H2O) D.v(O2)=v(NO)
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学选做题练习5(解析版) 题型:填空题
A~F均为元素周期表中前四周期元素,其相关信息如下表:
元素 | 相 关 信 息 |
A | A的基态原子最外层电子排布式为2s22p3 |
B | B是地壳中含量最高的元素 |
C | C+与B的简单离子的电子层结构相同 |
D | D的一种核素的质量数为64,中子数为35 |
E 、F | E 、F既同周期又同族,且原子序数F比E多2 |
请回答下列问题:
(1)D的价电子的电子排布式是 ;F原子的原子结构示意图为 。
(2)A、B的第一电离能的大小顺序为 。
(3)AB3-中A原子的杂化轨道类型为_____;与A2B互为等电子体的分子的分子式为 (任写一个即可)。
(4) D晶体的晶胞如图所示为面心立方最密堆积(在晶胞的顶点和面心均含有一个D原子)。则D的晶体中D原子的配位数为 。
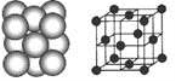
(5)已知17gA的简单氢化物催化氧化生成气态水时放出QkJ的热量,请写出A的简单氢化物催化氧化的热化学反应方程式 。
(6)C2B2的电子式为____;它可与E的二氯化物溶液反应,若反应的C2B2与E的二氯化物的物质的量之比为1:2,则该反应的化学反应方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学选做题练习5(解析版) 题型:填空题
有机物A、B的分子式均为C10H10O5,均能发生如下变化。
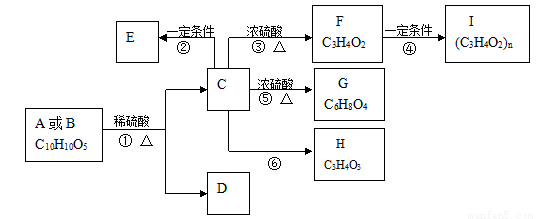
已知:
①A、B、C、D等均能与NaHCO3反应
②只有A、D能与FeCl3溶液发生显色反应,A苯环上的一溴代物只有两种
③F能使溴水褪色,
④H不能发生银镜反应
根据题意回答下列问题:
(1)反应③的反应类型是 ;有机物F含氧官能团的名称是 ;
(2)写出有机物的结构简式D 、H ;
(3)写出反应⑤的化学方程式 ;
(4)D的同分异构体有很多种,写出同时满足下列要求的所有同分异构体的结构简式 ;
①能与FeCl3溶液发生显色反应
②能发生银镜反应但不能水解
③苯环上的一卤代物只有2种
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学选做题练习3(解析版) 题型:填空题
Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用。
(1)与N3-含有相同电子数的三原子分子的空间构型是 。
(2)Cu具有良好的导电、导热和延展性,请解释Cu具有导电性的原因 。
(3)在Cu的催化作用下,乙醇可被空气氧化为乙醛,乙醛分子中碳原子的杂化方式是__________,乙醛分子中H—C—O的键角__________乙醇分子中的H—C—O的键角(填“大于”、“等于”或“小于”)。
(4)Cu+的核外电子排布式为 ,其在酸性溶液中不稳定,可发生歧化反应生成Cu2+和Cu,但CuO在高温下会分解成Cu2O,试从结构角度解释高温下CuO为何会生成Cu2O 。
(5)[Cu(H2O)4]2+为平面正方形结构,其中的两个H2O被Cl-取代有两种不同的结构,试画出[Cu(H2O)2(Cl)2]具有极性的分子的结构式 。
(6)Cu3N的晶胞结构下图所示:
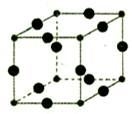
N3-的配位数为__________,Cu+半径为apm,N3-半径为b pm,Cu3N的密度__________g/cm3。(阿伏加德罗为常数用NA表示)
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学离子的性质及检验(解析版) 题型:填空题
某无色溶液只可能含有以下几种离子:①Mg2+、②Al3+、③Fe2+、④H+、⑤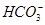 、⑥Cl-、⑦OH-。向其中缓慢地滴入NaOH溶液至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此可确定原溶液中一定含有的离子是
、⑥Cl-、⑦OH-。向其中缓慢地滴入NaOH溶液至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此可确定原溶液中一定含有的离子是
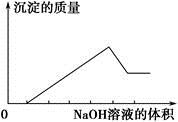
A.①②⑤ B.①③④ C.②⑥⑦ D.①②④⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com