
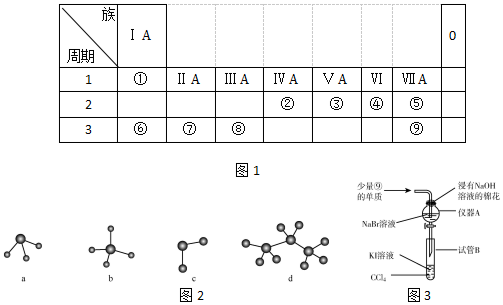
 .
. →
→ ,元素⑥和⑨形成的化合物中含有离子键.
,元素⑥和⑨形成的化合物中含有离子键.分析 由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为F、⑥为Na、⑦为Mg,⑧为Al,⑨为Cl,
(1)上述元素中,F的得电子能力最强;
(2)③号元素为N,原子序数为7,最外层5个电子;
(3)元素的非金属性越强,则气态氢化物越稳定;
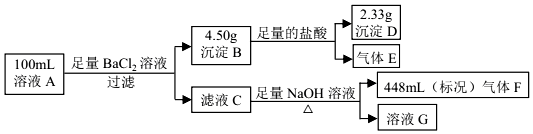
(4)根据分子模型判断物质的种类,①为H,②为C;
(5)金属性越强,则最高价氧化物对应水化物的碱性越强;
(6)NH3为共价化合物,NaCl是离子化合物;
(7)i.由图可知,A为分液漏斗,A中发生氯气与NaBr的氧化还原反应;
ii.棉花中浸有的NaOH溶液可吸收氯气,防止氯气扩散到空气中;
iii.溴与KI反应生成碘,碘易溶于四氯化碳;
iv.同主族元素从上到下,电子层、原子半径均增大,得到电子能力减弱.
解答 解:由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为F、⑥为Na、⑦为Mg,⑧为Al,⑨为Cl,
(1)上述元素中,F的得电子能力最强,则F的非金属性最强,故答案为:F;
(2)③号元素为N,原子序数为7,最外层5个电子,原子结构示意图为 ,故答案为:
,故答案为: ;
;
(3)在所给的元素中,非金属性最强的为F,故HF最稳定,故答案为:HF;
(4)①为H元素,②为C元素,二者形成的化合物为烃,题中a为NH3,b为CH4,c为H2O,d为C3H8,故答案为:bd;
(5)金属性Na>Mg>Al,则最高价氧化物对应水化物的碱性为NaOH>Mg(OH)2>Al(OH)3,故答案为:NaOH>Mg(OH)2>Al(OH)3;
(6)①和③组成的化合物为NH3,NH3为共价化合物,用电子式表示氨气分子的形成过程为:3H•+ →
→ ,NaCl是离子化合物,
,NaCl是离子化合物,
含离子键,
故答案为:3H•+ →
→ ;离子键;
;离子键;
(7)i.由图可知,A为分液漏斗,A中发生氯气与NaBr的氧化还原反应,该离子反应为2Br-+Cl2=Br2+2Cl-,
故答案为:分液漏斗;2Br-+Cl2=Br2+2Cl-;
ii.棉花中浸有的NaOH溶液可吸收氯气,防止氯气扩散到空气中,发生的离子反应为Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
iii.溴与KI反应生成碘,碘易溶于四氯化碳,充分振荡、静置,可观察到溶液分层,上层几乎无色,下层呈紫红色,
故答案为:溶液分层,上层几乎无色,下层呈紫红色;
iv.综上所述,由实验可知同主族元素从上到下,电子层数增多,原子半径逐渐增大,得到电子能力减弱,非金属性随元素核电荷数增加而逐渐减弱,
故答案为:逐渐增大.
点评 本题考查位置、结构及性质的关系及应用,为高频考点,把握元素的位置、性质及元素化合物知识为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | X的原子半径一定大于Y的原子半径 | |
| B. | Y的离子半径一定大于X的离子半径 | |
| C. | X与Y的简单离子不可能具有相同的电子层结构 | |
| D. | 两元素形成的化合物中,原子个数比不可能为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验室用氯化钠固体配制1.00mol/L的NaCl溶液500mL,回答下列问题:
实验室用氯化钠固体配制1.00mol/L的NaCl溶液500mL,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液 A 中一定存在 NH4+、SO42-、SO32-,可能存在 Na+ | |
| B. | 溶液 A 中一定存在 NH4+、Mg2+、SO42-、SO32-,可能存在 Cl- | |
| C. | 溶液 A 中可能存在 Cl-,且 c(Na+)≥0.20 mol•L-1 | |
| D. | 如果气体 F 能使湿润的蓝色石蕊试纸变红,说明溶液中一定含有 NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 反应温度/℃ | C(H2O2)/mol-L | V(H2O2)/mL | M(MnO2)/g | t/min |
| 1 | 20 | 2 | 10 | 0 | t1 |
| 2 | 20 | 2 | 10 | 0.1 | t2 |
| 3 | 20 | 4 | 10 | 0.1 | t3 |
| 4 | 40 | 2 | 10 | 0.1 | t4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳的结构式:O=C=O | B. | HF的电子式: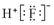 | ||
| C. | Cl-离子的结构示意图: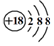 | D. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 如果苯酚浓溶液沾到皮肤上,应立即用自来水冲洗 | |
| B. | 受溴腐蚀致伤时,应先用苯和甘油洗伤口,再用水洗 | |
| C. | 检验氨基酸时,可向氨基酸溶液中加双缩脲试剂,会呈现紫玫瑰色 | |
| D. | 纸层析法点样时应用玻璃棒蘸取试样,在滤纸条原点处轻轻点样,晾干后再点,重复3〜5次 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molC2H4Cl2中含有共用电子对数目为7NA | |
| B. | 标准状况下,44.8 L丙三醇与足量金属钠反应,生成气体的分子数为3NA | |
| C. | 20℃时,1 mol己烷完全燃烧后恢复至原状态,生成气态物质分子数为6NA | |
| D. | 15g甲基正离子(CH3+)所含有的电子数是8NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com