
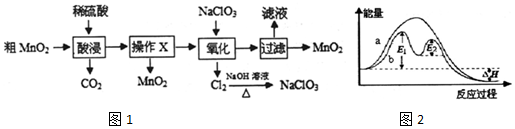
分析 粗MnO2(含有较多的MnO和MnCO3)样品加入硫酸,MnO2不溶于硫酸,所以加稀硫酸时样品中的MnO和MnCO3分别和硫酸反应生成可溶性的MnSO4,同时产生二氧化碳,过滤后得二氧化锰固体及含有硫酸锰的滤液,向滤液中加入氯酸钠,反应的离子方程式5Mn2++2ClO3-+4H2O=5MnO2↓+Cl2↑+8H+,将产生的氯气和热的氢氧化钠溶液反应可以得到氯酸钠的溶液,将反应后的溶液过滤得固体二氧化锰和滤液为含有硫酸的溶液.
(4)酸浸过程中得到的溶液所含主要溶质为MnSO4,根据阳极发生氧化反应,则为锰离子反应生成二氧化锰,据此书写;
(5)由图可知,a为反应2H2O2═2H2O+O2↑的能量变化,△H为其反应热,b为该反应加入催化剂的能量变化,反应活化能减小,△H不变,据此分析.
解答 解:(1)将粗MnO2粉碎、适当增大硫酸浓度、升高温度等可以加快酸浸速率;盐酸能与MnO2反应产生氯气,故不能用盐酸代替硫酸;
故答案为:将粗MnO2粉碎、适当增大硫酸浓度、升高温度等;否,盐酸能与MnO2反应产生氯气;
(2)粗MnO2样品加入硫酸,MnO2不溶于硫酸,所以加稀硫酸时样品中的MnO和MnCO3分别和硫酸反应生成可溶性的MnSO4,过滤后得二氧化锰固体及含有硫酸锰的滤液,氯酸钠氧化锰离子,反应为5Mn2++2ClO3-+4H2O=5MnO2↓+Cl2↑+8H+;
故答案为:过滤;5Mn2++2ClO3-+4H2O=5MnO2↓+Cl2↑+8H+;
(3)加热条件下Cl2与NaOH溶液反应,生成氯酸钠,该反应为:Cl2+6NaOH=5NaCl+NaClO3+3H2O,其氧化产物(NaClO3)和还原产物(NaCl)的物质的量之比为1:5;
故答案为:1:5;
(4)根据分析酸浸过程中得到的溶液所含主要溶质为MnSO4,电解该溶液也可制得MnO2和H2,阳极发生氧化反应,则阳极的反应式为:Mn2+-2e-+H2O=MnO2↓+4H+;
故答案为:MnSO4;Mn2+-2e-+H2O=MnO2↓+4H+;
(5)a.由图可知,反应的能量降低,该反应为放热反应,热效应为△H<0,故a错误;
b.反应历程b活化能降低,但不影响反应的反应热,应为有催化剂参加,故b正确;
c.有催化剂时,活化能降低,不为E1+E2,故c错误;
d.改变催化剂,可改变该反应的活化能,故d正确;
故答案为:bd.
点评 本题通过MnO2的提纯综合考察了常见的基本实验操作、氧化还原方程式的配平、产物的判断及有关计算,为高频考点,把握流程中发生的化学反应及混合物分离方法为解答的关键,侧重分析能力及推断能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| 实验步骤 | 实验结论 |
| ①氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 | 氧化性从强到弱的顺序:氯、溴、碘 |
| ②NaBr溶液+氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 | |
| ③KI溶液+氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 |
| A. | 完成该实验需用到的实验仪器有试管和胶头滴管 | |
| B. | CCl4在实验中所起的作用是萃取剂 | |
| C. | ③中反应的离子方程式为Cl2+2I-═2Cl-+I2 | |
| D. | 上述三步实验能很好的探究卤素单质的氧化性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,2,7,7-四甲基辛烷的一氯取代物有4种 | |
| B. | 甲醇与分子式为C3H8O的某种有机物相差2个CH2原子团,故它们一定互为同系物 | |
| C. | 苯与浓硝酸、浓硫酸共热并保持50~60℃反应生成硝基苯 | |
| D. | 甲烷和 Cl2的反应与乙烯和 Br2的反应属于同一类型的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 起始浓度 | 甲 | 乙 | 丙 |
| c(N2)/mol•L-1 | 0.46 | 0.46 | 0.92 |
| c(O2)/mol•L-1 | 0.46 | 0.23 | 0.92 |
| A. | 起始时,反应速率:丙>甲>乙 | B. | 平衡时,c(NO):甲=丙>乙 | ||
| C. | 平衡时,N2的转化率:甲>乙 | D. | 平衡时,甲中c(N2)=0.4 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
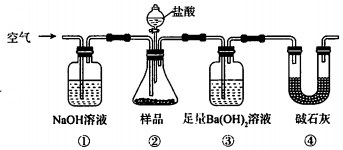
| A. | 必须在②③间添加吸收HCl的装置 | |
| B. | ④的作用是防止空气中的气体影响实验的精确度 | |
| C. | 通入空气的作用是保证②中产生的气体完全转移到③中 | |
| D. | 称取样品和③中产生的沉淀的质量即可求算Na2CO3固体的纯度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将KI溶液滴入FeCl3溶液中,加入CCl4,振荡、静置 | 下层溶液显紫色 | 还原性:Fe2+<I- |
| B | 将SO2通入滴有酚酞的NaOH溶液中 | 溶液红色褪去 | SO2具有漂白性 |
| C | 将稀盐酸滴入Na2SiO3溶液中 | 溶液中出现凝胶 | 非金属性:Cl>Si |
| D | 将稀硫酸滴入淀粉溶液中,加热一段时间,再加入新制的Cu(OH)2悬浊液并加热 | 溶液中未出现砖红色沉淀 | 淀粉未水解 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水(AgNO3溶液) | B. | NaOH溶液[Ba(OH)2溶液] | ||
| C. | FeSO4溶液(KSCN溶液) | D. | KI溶液(淀粉溶液) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐卤点豆腐,明矾净水和利用电泳来分离各种氨基酸和蛋白质都与胶体的性质有关 | |
| B. | 人工制造的铝硅酸盐分子筛可用作吸附剂和催化剂载体 | |
| C. | 生物柴油可以用廉价油脂与甲醇发生酯交换反应制得,属于不可再生能源 | |
| D. | 在建的国产航母采用了新的防腐蚀技术,传统的船舶防腐蚀技术是在船体上焊接一些锌块,原理是采用牺牲阳极的阴极保护法 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com