
Cl2是纺织工业常用的漂白剂,Na2S2O3可作为漂白布匹后的“脱氯剂”。
S2O32-和Cl2反应的产物之一为SO42-。下列说法不正确的
A.上述反应中,每生成l mol SO42-,可脱去1 mol Cl2
B.H2O参与该反应,既不做氧化剂又不做还原剂
C.根据该反应可判断氧化性:Cl2 > SO42-
D.该反应中还原剂是S2O32-
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
① CO(g)+2H2(g)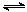 CH3OH(g) △H 1=-90.7 kJ·mol-1
CH3OH(g) △H 1=-90.7 kJ·mol-1
② 2CH3OH(g)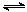 CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1
③ CO(g)+H2O(g)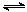 CO2(g)+H2(g) △H 3=-41.2kJ·mol-1
CO2(g)+H2(g) △H 3=-41.2kJ·mol-1
回答下列问题:
(1)则反应3H2(g)+3CO(g)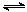 CH3OCH3(g)+CO2(g)的△H= ▲ kJ·mol-1。
CH3OCH3(g)+CO2(g)的△H= ▲ kJ·mol-1。
(2)下列措施中,能提高CH3OCH3产率的有 ▲ 。
A.使用过量的CO B.升高温度 C.增大压强
(3)反应③能提高CH3OCH3的产率,原因是 ▲ 。
(4)将合成气以n(H2)/n(CO)=2通入1 L的反应器中,一定条件下发生反应:
4H2(g)+2CO(g) 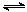 CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是 ▲ 。
CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是 ▲ 。
A.△H <0
B.P1<P2<P3
C.若在P3和316℃时,起始时n(H2)/n(CO)=3,则达到平衡时,CO转化率小于50%[
(5)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚。观察图2回答问题。催化剂中n(Mn)/n(Cu)约为 ▲ 时最有利于二甲醚的合成。
(6)图3为绿色电源“二甲醚燃料电池”的工作原理示意图,a电极的电极反应式为 ▲ 。
(7)甲醇液相脱水法制二甲醚的原理是:CH3OH +H2SO4→CH3HSO4+H2O,
CH3 HSO4+CH3OH→CH3OCH3+H2SO4。与合成气制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一个2L的容器中,放入2mol气体A,5分钟后,测得这种气体A还剩余0.5mol,该反应中气体A的化学反应速率是:
A.1.5mol/(L·min) B.0.15mol/(L·min)
C.0.75mol/(L·min) D.0.075mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
Ⅰ:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=206.0 kJ·mol-1
Ⅱ:CO(g)+2H2(g)=CH3OH(g) ΔH=-129.0 kJ·mol-1
(1)CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为____________________。
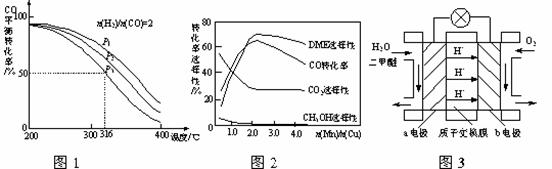
(2)将1.0 mol CH4和2.0 mol H2O(g)通入容积为100 L的反应室,在一定条件下发生反应Ⅰ,测得在一定的压强下CH4的转化率与温度的关系如右图。
 ①假设100 ℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为________。
①假设100 ℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为________。
②100 ℃时反应Ⅰ的平衡常数为________。
(3)在压强为0.1 MPa、温度为300 ℃条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下发生反应Ⅱ生成甲醇,平衡后将容器的容积压缩到原来的1/2,其他条件不变,对平衡体系产生的影响是________(填字母序号)。
A.c(H2)减少
B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加
D.重新平衡c(H2)/c(CH3OH)减小
E.平衡常数K增大
(4) 写出甲醇-空气-KOH溶液的燃料电池负极的电极反应式:______________________。
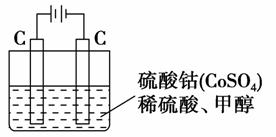 (5)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用如图装置模拟上述过程:
(5)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用如图装置模拟上述过程:
①写出阳极电极反应式________。
②写出除去甲醇的离子方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验现象的描述正确的是
A.氢气在氯气中燃烧,发出苍白色火焰,瓶口上方有白色烟雾
B.向碳酸钠、碳酸氢钠的饱和溶液中滴加酚酞,仅前者溶液变红
C.铜在氯气中燃烧,产生棕黄色烟
D.在硫酸亚铁溶液中滴加稀K3[Fe(CN)6]后,变为特征性蓝色溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法正确的是
A.25℃ 101kPa时,CH4(g)+2O2(g)=CO2(g) +2H2O(g) △H=-Q kJ/mol,
则甲烷的燃烧热为Q kJ/mol
B.CaCO3(s)=CaO(s)+CO2(g) 室温下不能自发进行,说明该反应的
ΔH<0
C.反应N2(g)+3H2(g) 2NH3(g)ΔH<0达到平衡后,升高温度,反
2NH3(g)ΔH<0达到平衡后,升高温度,反
应速率v(H2)和H2的平衡转化率均增大
D.已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2的值
均大于零):
H2(g) +Cl2(g)=2HCl(g) △H1=—Q1 kJ/mol
H2(g) +Br2(g)=2HBr(g) △H2=—Q2 kJ/mol 则△H1<△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,向一体积为2 L的恒容密闭容器中充入2 mol A、1mol B,发生如下反应:2A(g)+B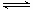 3C(g) △H=—Q kJ/mol(Q>0)。经过60 s达到平衡,测得B物质的量为0.2 mol,下列对该平衡的叙述正确的是
3C(g) △H=—Q kJ/mol(Q>0)。经过60 s达到平衡,测得B物质的量为0.2 mol,下列对该平衡的叙述正确的是
A.用A浓度表示该反应速率为1.6 mol/(L•min)
B.若使容器变为1 L,则B的物质的量一定减小
C.达到平衡,测得放出热量为x kJ,则x=Q
D.若向容器再充入1 mol C,重新达到平衡,A的体积分数保持不变,则B为气态
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,水的电离达到平衡:H2O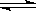 H++OH—;ΔH>0,下列叙述正确的是
H++OH—;ΔH>0,下列叙述正确的是
A.向水中加入稀氨水,平衡逆向移动,c(OH―)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水加热,Kw增大,pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值,下列说法正确的是 ( )。
A.1 L 0.1 mol·L-1的氨水中含有的NH3分子数为0.1 NA
B.标准状况下,2.24 L的CCl4中含有的C—Cl键数为0.4 NA
C.常温常压下,3.0 g含甲醛的冰醋酸中含有的原子总数为0.4 NA
D.常温常压下,Na2O2与足量CO2反应生成2.24 L O2,转移电子数为0.2 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com