
| A. | 用容量瓶配制溶液时,必须先用该溶液润洗 | |
| B. | 在蒸馏实验时常加入碎瓷片以防止暴沸 | |
| C. | 可用碱式滴定管量取20.00mLKMnO4溶液 | |
| D. | 分液操作中,待下层液体流出后,再将上层液体从分液漏斗下口放出 |
科目:高中化学 来源: 题型:选择题
| A. | 2种 3种 | B. | 3种 2种 | C. | 3种 4种 | D. | 2种 2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由SO2制亚硫酸钠:SO2$\stackrel{Na_{2}CO_{3}溶液}{→}$NaHSO3溶液$→_{调节溶液的pH}^{NaOH溶液}$Na2SO3溶液 | |
| B. | 由NaCl制漂粉精:NaCl(aq)$\stackrel{电解}{→}$Cl2$\stackrel{澄清石灰水}{→}$漂粉精 | |
| C. | 由NH3制硝酸:NH3$\stackrel{O_{2}}{→}$NO2$\stackrel{H_{20}}{→}$HNO3 | |
| D. | 由乙烯制乙酸:H2C=CH2$→_{催化剂}^{H_{20}}$CH3CH2OH$→_{△}^{Cu/O_{2}}$CH3CHO$→_{△}^{新制银氨溶液}$CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的苯和苯甲酸完全燃烧消耗氧气的量相等 | |
| B. | 乙酸乙酯在H218O中水解,产物乙酸中将含有18O同位素 | |
| C. | 淀粉与稀硫酸混合加热一段时间后,滴加碘水溶液变蓝,说明淀粉没有水解 | |
| D. | Na2SO4•10H2O失水时吸热,结晶时放热,因而该晶体可作储热材料实现化学能与热能相互转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最高价氧化物对应水化物的酸性:w>Z>x | |
| B. | 化合物Q中存在两种类型的共价键 | |
| C. | Z、X都可以形成两种常见的酸性氧化物 | |
| D. | 四种元素的常见单质中X的单质的沸点最高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
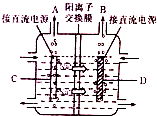 氯碱工业是基础化学工业,其产品广泛用于化工、冶金、造纸、纺织、石油等工业.
氯碱工业是基础化学工业,其产品广泛用于化工、冶金、造纸、纺织、石油等工业.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 347kJ/mol | B. | 368 kJ/mol | C. | 386 kJ/mol | D. | 414 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
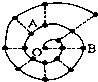 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )| A. | 离O点越远的元素原子半径越大 | |
| B. | 虚线相连的元素处于同一族 | |
| C. | B元素是图中金属性最强的元素 | |
| D. | A、B组成的化合物中可能含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com