
下列说法正确的是
A.铅蓄电池在放电过程中,负极质量减小,正极质量增加
B.原子核内有10 个中子的氧原子
个中子的氧原子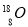
C.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
D.新制饱和氯水在光照下有气泡产生,其主要成分是氯气
 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案科目:高中化学 来源:2014-2015山西省太原市高二4月阶段形成检测化学试卷(解析版) 题型:选择题
电子构型为[Ar]3d54s2的元素是
A.稀有气体 B.过渡元素 C.主族元素 D.卤族元素
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省杭州市下学期高二4月月考化学试卷(解析版) 题型:选择题
由CH3CH3→CH3CH2Cl→CH2 = CH2→CH3CH2OH的转化过程中,经过的反应是
A.取代→消去→加成 B.裂解→取代→消去
C.取代→加成→氧化 D.取代→消去→水解
查看答案和解析>>
科目:高中化学 来源:2014-2015吉林省高二下学期第一次月考化学试卷(解析版) 题型:选择题
下列实验能获得成功的是
A.苯和浓溴水用Fe作为催化剂制溴苯
B.氯乙烷与NaOH溶液共热,在水解后的溶液中加入AgNO3溶液检验Cl-
C.CH4与Cl2在光照条件下得到纯净的CH3Cl
D.乙烯通入溶有Br2的CCl4溶液可得 CH2BrCH2Br
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东齐鲁名校教科研协作体19所名校高三第二次调研化学试卷(解析版) 题型:实验题
(9分)某校学生化学实验小组,为验证非金属元素氯的氧化性强于硫和氮,设计了一套实验装置:(部分夹持装置已略去)
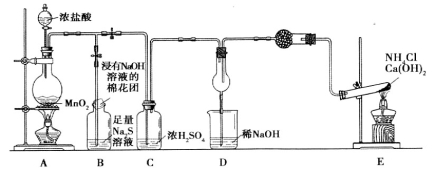
(1)写出A中反应的离子方程式_________。
(2)实验中证明氧化性Cl2>S的离子方程式为___________。
(3)D中干燥管中产生大量白烟,该反应的化学方程式为________。
(4)有同学认为D中的现象并不能说明氯的氧化性大于氮,需要在C之前加装洗 气装置,该装置中盛装的试剂名称为____
气装置,该装置中盛装的试剂名称为____
(5) E装置中反应的化学方程式为_______________________。
E装置中反应的化学方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东齐鲁名校教科研协作体19所名校高三第二次调研化学试卷(解析版) 题型:选择题
下列与 实验相关的叙述中,正确的是
实验相关的叙述中,正确的是
A.加热NH4C1晶体时,将湿润的红色石蕊试纸靠近试管口,检验NH3的生成
B.向某溶液中加入足量盐酸酸化,无现象,再加 入BaC
入BaC l2溶液,有白色沉淀生成,说明原溶液中存在SO42—
l2溶液,有白色沉淀生成,说明原溶液中存在SO42—
C.取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+
D.用饱和碳酸 钠溶液除去二氧化碳中的氯化氢
钠溶液除去二氧化碳中的氯化氢
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东齐鲁名校教科研协作体19所名校高三第二次调研化学试卷(解析版) 题型:选择题
下列说法正确的是
A.玻璃钢是一种复合材料,由基体和 增强体组成,基体起骨架作用
增强体组成,基体起骨架作用
B.SO2溶于水,其水溶液能导电,说明SO2是电解 质
质
C.食醋、纯碱、食盐分别属于酸、碱、盐
D.生铁、不锈钢、青铜都属于合金
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省济宁市高三第二次模拟化学试卷(解析版) 题型:填空题
(选考)镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、炭粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行资源回收研究,并设计出相关实验流程图
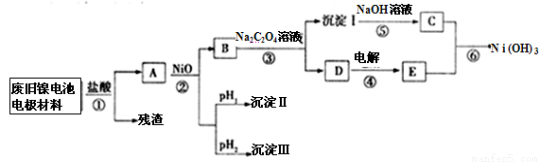
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+
②某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如表所示:
M(OH)n | Ksp | pH | |
开始沉淀 | 沉淀完全 | ||
Al(OH)3 | 1.9×10-33 | 3.43 | 4.19 |
Fe(OH)3 | 3.8×10-38 | 2.53 | 2.94 |
Ni(OH)2 | 1.6×10-14 | 7.60 | 9.75 |
回答下列问题:
(1)根据表数据判断步骤②依次析出沉淀Ⅱ 和沉淀Ⅲ (填化学式),则pH1 pH2(填填“>”、“=”或“<”),控制两种沉淀析出可利用 。.
A.pH试纸 B.石蕊指示剂 C.pH计
(2)已知溶解度:NiC2O4>NiC2O4H2O>NiC2O42H2O,则反应③的化学方程式是 。第③步反应后,过滤沉淀时需要的玻璃仪器有 .若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因 、 。
(3)④中阳极反应产生的气体E为 ,验证该气体的试剂为 。
(4)试写出反应⑥的离子方程式_____________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省泰州市高三第二次模拟考试化学试卷(解析版) 题型:实验题
(12分)锌浮渣主要含Zn、ZnO、SiO2、Fe2+、Cd2+、Mn2+,工业上可通过控制条件逐一除去杂质以制备超细活性氧化锌,其工艺流程如下:
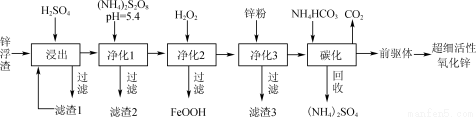
(1)锌浮渣利用硫酸浸出后,将滤渣1进行再次浸出,其目的是____。
(2)净化1是为了将Mn2+转化为MnO2而除去,写出该反应的离子方程式:____。
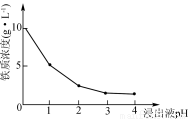
(3)90℃时,净化2溶液中残留铁的浓度受pH影响如右图所示。pH较小时,虽有利于Fe2+转化为Fe3+,但残留铁的浓度仍高于pH为3~4时的原因是____________________________。
(4)滤渣3的主要成分为________(填化学式)。
(5)碳化在50℃进行,“前驱体”的化学式为ZnCO3·2Zn(OH)2·H2O,写出碳化过程生成“前驱体”的化学方程式:____;碳化时所用NH4HCO3的实际用量为理论用量的1.1倍,其原因一是为了使Zn2+充分沉淀,二是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com