
已知常温下,0.1mol/L的一元酸HA溶液的pH>1;0.1mol/L的一元碱MOH溶液中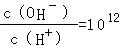 ,将此两种溶液等体积混合,混合夜中,离子浓度关系不正确的是( )
,将此两种溶液等体积混合,混合夜中,离子浓度关系不正确的是( )
A.c(OH﹣)=c(HA)+c(H+)
B.c(M+)>c(A﹣)>c(OH﹣)>c(H+)
C.c(A﹣)>c(M+)>c(H+)>c(OH﹣)
D.c(M+)+c(H+)=c(A﹣)+c(OH﹣)
C
解析试题分析:0.1mol/L的一元酸HA溶液的pH>1,则酸部分电离,为弱酸;0.1mol/L的一元碱MOH溶液中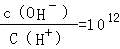 ,结合水的离子积常数知,
,结合水的离子积常数知,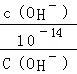 =1012,则溶液中氢氧根离子浓度=0.1mol/L,所以碱为强碱,二者等体积混合时恰好反应生成强碱弱酸盐,根据盐的性质及电荷守恒分析解答.
=1012,则溶液中氢氧根离子浓度=0.1mol/L,所以碱为强碱,二者等体积混合时恰好反应生成强碱弱酸盐,根据盐的性质及电荷守恒分析解答.
解:0.1mol/L的一元酸HA溶液的pH>1,则酸部分电离,为弱酸;0.1mol/L的一元碱MOH溶液中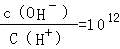 ,结合水的离子积常数知,
,结合水的离子积常数知,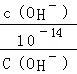 =1012,则溶液中氢氧根离子浓度=0.1mol/L,所以碱为强碱,二者等体积混合时恰好反应生成强碱弱酸盐,
=1012,则溶液中氢氧根离子浓度=0.1mol/L,所以碱为强碱,二者等体积混合时恰好反应生成强碱弱酸盐,
A.根据质子守恒得c(OH﹣)=c(HA)+c(H+),故A正确;
B.该溶液的溶质是盐,且该盐是强碱弱酸盐其溶液呈碱性,则c(OH﹣)>c(H+),根据电荷守恒得c(M+)>c(A﹣),盐溶液中酸根离子浓度大于氢氧根离子浓度,所以该溶液中离子浓度大小顺序是c(M+)>c(A﹣)>c(OH﹣)>c(H+),故B正确;
C.该溶液的溶质是盐,且该盐是强碱弱酸盐其溶液呈碱性,则c(OH﹣)>c(H+),根据电荷守恒得c(M+)>c(A﹣),盐溶液中酸根离子浓度大于氢氧根离子浓度,所以该溶液中离子浓度大小顺序是c(M+)>c(A﹣)>c(OH﹣)>c(H+),故C错误;
D.根据电荷守恒得c(M+)+c(H+)=c(A﹣)+c(OH﹣),故D正确;
故选:C.
考点:离子浓度大小的比较
点评:本题考查了混合溶液定性判断,正确判断酸及碱的强弱是解本题关键,结合溶液中的溶质及电荷守恒来分析解答即可,难度中等.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(OH-) |
| c(H+) |
查看答案和解析>>
科目:高中化学 来源:2013届辽宁省盘锦市第二高级中学高三第二次阶段考试化学试卷(带解析) 题型:填空题
(8分)(1)已知断开1 mol H2中的化学键需吸收436 kJ热量,断开1 mol Cl2中的化学键需要吸收243 kJ能量,而形成1 molHCl分子中的化学键要释放431 kJ能量,试求1 mol H2与1 mol Cl2反应的能量变化。△H= 。
(2)已知常温时,0.1mol/L某一元酸HA在水中有0.1%发生电离,则该溶液的PH=___①___,此酸的电离平衡常数K=___②___,由HA电离出来的H+的浓度约为水电离出来的H+的浓度的__③__倍。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年辽宁省盘锦市高三第二次阶段考试化学试卷(解析版) 题型:填空题
(8分)(1)已知断开1 mol H2中的化学键需吸收436 kJ热量,断开1 mol Cl2中的化学键需要吸收243 kJ能量,而形成1 molHCl分子中的化学键要释放431 kJ能量,试求1 mol H2与1 mol Cl2反应的能量变化。△H= 。
(2)已知常温时,0.1mol/L某一元酸HA在水中有0.1%发生电离,则该溶液的PH=___①___,此酸的电离平衡常数K=___②___,由HA电离出来的H+的浓度约为水电离出来的H+的浓度的__③__倍。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com